Вариант 3
1. Электронная конфигурация атома калия
A) 1s2 2s2 2p6 3s2 3p6 3d10 4s1
B) 1s2 2s2 2p6 3s1
C) 2s2 2s1
D) 1s2 2s2 2p1
E) 1s2 2s2 2p6 3s2 3p6 4s2
2. В образовании металлической кристаллической решетки принимают участие
A) Электроны, анионы, атомы
B) Только катионы металлов
C) Только атомы металлов
D) Только электроны
E) Электроны, катионы, атом
3. При окислении происходит
A) Отдача электронов атомом, молекулой или ионом
B) Присоединение электронов
C) Перемещение электронной пары
D) Образование общей электронной пары
E) Завершение внешнего энергетического уровня
4Какой из неметаллов образуют высший оксид типа R2O5
А ) S В) C С) N D) Si E) F?
.5Не является аллотропной модификацией углерода:
A) Карбин B) Поликумулен C) Графит
D) Карбид E) Алмаз
6. Реакция замещения:
A) CuCO3 → CuO + CO2
B) CuSO4 + Fe → Cu + FeSO4
C) 2Cu + O2 → 2 CuO
D) Cu(OH)2 + 2HCl → CuCl2 + 2H2O
E) CuO + H2SO4 → CuSO4 + H2O
7. Общая сумма коэффициентов в ионном полном уравнении реакции взаимодействия фосфата натрия и хлорида кальция составляет:
A) 32
B) 30
C) 25
D) 18
E) 12
8.Наибольшую массу имеет 2 моль карбоната
A) кальция B) натрия C) калия D) стронция
E) бария
9. Схема реакции, в результате которой образуется кремниевая кислота:
A) Si + H2SO4
B) SiO2 + KOH
C) SiO2 + H2O
D) Si + HNO3
E) K2SiO3 + HCl
10 .Кислые соли состоят из
A) катионов металлов и кислотных остатков
B) кислотных остатков и гидроксогрупп, связанных с катионами
C) двух химически разных катионов и кислотного остатка
D) кислотных остатков с незамещенными ионами водорода и катионов металлов
E) внешней и внутренней сферы, которая включает комплексообразователь и лиганды
11. Вид связи в оксидах углерода (II) и (IV)
A) Ковалентный неполярный
B) Ионный
C) Водородный
D) Металлический
E) Ковалентный полярный
12. Реакция, в которой одновременно образуются осадок белого и синего цвета, это
A) CuCl2 + Al2(SO4)3
B) CuSO4 + Ba(OH)2
C) Al2(SO4)3 + NaOH
D) Ba(OH)2 + Al2(SO4)3
E) NaOH + CuSO4
13. При взаимодействии 3 моль оксида алюминия и 294 г серной кислоты, получится количество вещества соли (в молях)
A) 2
B) 3
C) 5
D) 4
E) 1
14. Виноградным сахаром иногда называют
A) Крахмал
B) Целлюлозу
C) Сахарозу
D) Рибозу
E) Глюкозу
15. В схеме превращений
Fe —cl2—> A —NaOH—> Б —t0c—> В —Hcl—> Г
вещества А, В, Г
A) FeCl3, Fe2O3, FeCl3
B) FeCl2, Fe, FeCl3
C) FeCl2, FeO, FeCl2
D) FeCl3, FeO, FeCl2
E) FeCl3, Fe2O3, FeCl2
16.Кислота, которая не диссоциирует
A) H3PO4
B) HCl
C) H2SO4
D) H2SiO3
E) HNO3
17 Раствор хлорида алюминия имеет среду:
A) Индифферентную
B) Кислую
C) Нейтральную
D) Слабощелочную
E) Щелочную
18. Только ковалентная полярная связь в
A) HCl
B) NaCL
C) Cu
D) H2
E) Al2O3
19 . Количество электронов в катионе Fe+3
A) 29 B) 26 C) 23 D) 22 E) 25
20 Из оксида углерода (II) объемом 20 л можно получить оксид углерода (IV) объемом:
A) 20 л
B) 4,48 л
C) 2 л
D) 10 л
E) 44,8 л
21 .Число электронов, которое может принять атом азота равно: A) 5,B) 2,
C) 3, D) 1 E) 1.
22. Для сжигания кремния количеством вещества 0,5 моль потребуется кислород объемом (н.у.)
A) 11,2 л
B) 1,12 л
C) 5 л
D) 112 л
E) 0,5 л
23. . Сумма всех коэффициентов в уравнении реакции
Na2CO3 + HCl NaCl + H2O + CO2
A) 3 B) 5 C) 7 D) 9 E) 1
24 Массовая доля кислорода в серной кислоте равна (%):
A) 100,48
B) 91,54
C) 60,45
D) 65,31
E) 71,23
25. Если смещать 5 г соли и 95 г воды, то получится …. % — ный раствор
A) 5
B) 9
C) 12
D) 8
E) 10
26. Основные оксиды – это оксиды, которым соответствуют:
A) соли
B) основания
C) гидриды
D) растворении в воде образуют кислоты
E) кристаллогидраты
27 Названиям: гашёная известь, известковое молоко, известковая вода- соответствует формула A) СаО, B) Са(ОН)2 ,C) СаС2 , D) CaCO3 E) CaCL2
28Водород образуется при действии
A) Раствора соляной кислоты на медь
B) Концентрированной азотной кислоты на магний
C) Раствора серной кислоты на оксид цинка
D) Раствора cоляной кислоты на цинк
E) Раствора азотной кислоты на магний
29 При взаимодействии гидроксида калия и серной кислоты образуеются
A) K и H2SO3 B) H2SO4 и H2O C) K2O и H2SO3
D) K2SO4 и H2O E) K2S и H2O
30. Вещество С в цепи превращения: H2SO3 -> SO2 -> SO3 -> C -> H2
A) Серная кислота
B) Сероводородная кислота
C) Сульфат натрия
D) Сернистая кислота
E) Сульфид калия
Презентация на тему: » Тема: Соединения щелочных металлов Тест по теме: Щелочные металлы. Ответы: 1- г 2 — в 3 — б 4 — в 5 — а 6 — г 7 — б 8 — а 9 — б 10 — в. Шкала оценивания:» — Транскрипт:
1
Тема: Соединения щелочных металлов Тест по теме: Щелочные металлы. Ответы: 1- г 2 — в 3 — б 4 — в 5 — а 6 — г 7 — б 8 — а 9 — б 10 — в. Шкала оценивания: нет ошибок – «5», 1,2 ошибки – «4», 3,4 ошибки – «3», более – «2» Д/з § 11, упр. 1 (б) стр К щелочным металлам не относится: а) рубидий; в) калий; б) цезий; г) медь. 2.Электронная формула 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 соответствует элементу: а) литию; в) калию; б) натрию; г) меди. 3.Радиус атома у элементов I группы главной подгруппы с увеличением заряда ядра: а) изменяется периодически; в) не изменяется; б) увеличивается; г) уменьшается. 4.Щелочные металлы проявляют очень сильные: а) окислительные свойства; в) восстановительные свойства; б) амфотерные свойства; г) нейтральные свойства. 5.Во всех своих соединениях щелочные металлы проявляют степень окисления: а) +1; в) +2; б) +3; г) К физическим свойствам щелочных металлов не относится: а) серебристо-белые ; в) хорошие электропроводники; б) мягкие и легкие; г) тугоплавкие. 7. При взаимодействии элементов I группы главной подгруппы с водой образуется: а) кислота; в) оксид и выделяется водород; б) щелочь и выделяется водород; г) соль. 8. При взаимодействии кислорода со щелочными металлами оксид образуется только с: а) литием; в) калием; б) натрием; г) рубидием. 9. Щелочные металлы не взаимодействуют с: а) неметаллами; в) водой; б) растворами кислот; г) концентрированными кислотами. 10. Натрий и калий хранят в керосине или в минеральном масле, потому что они: а) имеют резкий запах; в) легко окисляются на воздухе; б) очень легкие; г) сильные окислители.

2
1. Оксиды щелочных металлов а) физические свойства: б) химические свойства:

3
2. Гидроксиды щелочных металлов а) физические свойства: б) химические свойства: Инструкция 1.Налейте в чистую пробирку гидроксид натрия, добавьте несколько капель фенолфталеина. Что наблюдаете? 2.Добавьте в эту же пробирку раствор соляной кислоты. Что наблюдаете? Запишите уравнение реакции. 3.Налейте в чистую пробирку гидроксид натрия и добавьте раствор сульфата меди. Что наблюдаете? Запишите уравнение реакции
4.В пробирку с гидроксидом цинка осторожно добавьте гидроксид натрия. Что наблюдаете? Запишите уравнение реакции
Сделайте вывод о химических свойствах гидроксидов щелочных металлов.
4
2. Гидроксиды щелочных металлов в) применение: Гидроксид натрия – NaOH – едкий натр, каустическая сода, каустик. Гидроксид калия – КОН – едкое кали. NaOH и КОН – едкие щелочи, разъедают ткани и бумагу
5
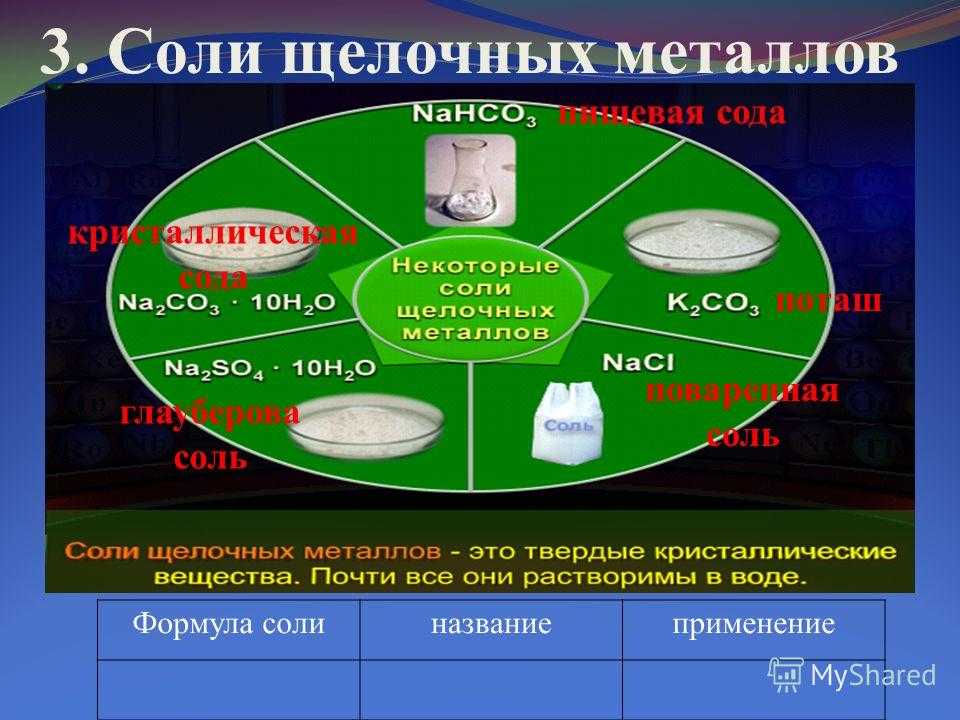
3. Соли щелочных металлов Формула солиназваниеприменение пищевая сода поташ поваренная соль глауберова соль кристаллическая сода
6
4. Значение соединений щелочных металлов в жизнедеятельности организмов Ионы натрия и калия играют большую биологическую роль: Na + — главный внеклеточный ион, содержится в крови и лимфе, а К + — основной внутриклеточный ион. Соотношение концентрации этих ионов регулирует давление крови в живом организме и обеспечивает перемещение растворов солей из корней в листья растений. Ионы калия — поддерживают работу сердечной мышцы, помогают при ревматизме, улучшают работу кишечника. Соединения калия – устраняют отеки.

7
Взрослый человек должен в сутки потреблять с пищей 3,5г ионов калия. Задача. В 100г кураги содержится 2,034г калия. Сколько граммов кураги нужно съесть, чтобы получить суточную норму калия? Итог урока: 1.Какие физические и химические свойства характерны для оксидов, гидроксидов щелочных металлов. 2.Где применяются гидроксиды и соли щелочных металлов Спасибо за работу.

2 вариант
1. Электронное строение атома кремния
A) 1s2 2s2 2p6 3s2 3p1
B) 1s2 2s2 2p6 3s2 3p2
C) 1s2 2s2 2p6 3s2 3p5
D) 1s2 2s2 2p6 3s2 3p3
E) 1s2 2s2 2p6 3s2 3p6
2. . Уравнение диссоциации нитрата магния
A) Mg(NO3)2 (реакция обмена) Mg4+ + 2NO32-
B) Mg(NO3)2 (реакция обмена) Mg2+ + 2N5+ + 6O2-
C) Mg(NO3)2 (реакция обмена) Mg2+ + NO32-
D) Mg(NO3)2 (реакция обмена) Mg2+ + 2NO3 —
E) Mg(NO3)2 (реакция обмена) Mg3+ + N2O4- + 2O-
3. При реакции соединения:
A) в реакцию вступают два сложных вещества, при этом они обмениваются своими составными частями
B) из одного вещества образуется несколько более простых веществ
C) простое вещество реагирует с более сложным, при этом образуется два сложных вещества
D) из нескольких веществ образуется одно более сложное вещество
E) в реакцию вступают простое и сложное вещества, при этом атомы простого вещества замещают одни из атомов сложного
4. .В молекуле кислорода связь
A) Ионная
B) Донорно-акцепторная
C) Ковалентная полярная
D) Металлическая
E) Ковалентная неполярная
5. Формулы неизвестных веществ в схеме: Zn -> ZnO -> ZnCl2 —NaOH—-> ? —-+NaOH—>
A) Zn(OH)2; ZnCl2
B) NaCl; Zn(OH)2
C) Zn(OH)2; ZnO
D) Zn; Zn(OH)2
E) Zn(OH)2; Na2
6. Щелочные металлы находятся в главной подгруппе группы номер
A) 3
B) 1
C) 2
D) 5
E) 7
7. Количество вещества нитрата аммония, которое образуется при пропускании 11,2 л аммиака (н.у.) через 126 г азотной кислоты
A) 0,5 моль
B) 1 моль
C) 2 моль
D) 5 моль
E) 0,2 моль
8. Для полной нейтрализации раствора, содержащего 14 г гидроксида калия, необходим оксид серы (IV) объемом (при н.у.)
A) 9,6 л
B) 8,6 л
C) 2,8 л
D) 5,6 л
E) 7,2 л
9 Если схема реакции
Ag —-+HNO3(конец)—-> A —+o2+N20—-> Б —NaOH—> В —t 0 c—> NaNO2
то сумма молекулярных масс веществ А и В равна A) 109 B) 10,9 C) 93 D) 100
E) 115
10.Не происходит выпадение осадка в случае взаимодействия
A) силиката натрия и нитрата кальция
B) сульфата калия и нитрата бария
C) карбоната калия и нитрата натрия
D) хлорида натрия и нитрата серебра
E) сульфида калия и нитрата меди (II)
11. Для определения углекислого газа можно использовать соединения кальция:
A) Са(ОН)2, B) СаСl2, C) CaO, D) Ca(HCO3)2 E) CaCO3
12 Оба вещества могут быть только окислителями:
A) SO3 H2SO3
B) HNO3 H2 SO4
C) SO2 CO2
D) SO2 H2SO4
E) NO HNO3
13.Формула аллотропного видоизменения кислорода
A) О-1
B) О-2
C) О3
D) О
E) О2
14. .Формула, соответствующая высшему оксиду элементов VI А группы:
A) R2O
B) RO
C) R2O3
D) RO3
E) RO2
15.Формулы соединений (a, b, d) и условие протекания реакции (с) по схеме:
С —a—> СО2 —b—> СаСО3 —c—> СаО —d—> СаС2
A) а – H2O; b – CaC2; c – давление p; d – CH4
B) a – O2; b – H2CO3; c – to; d – CO
C) a – O2; b – Ca(OH)2; c – to; d — C
D) a – O2; b – K2CO3; c – to; d – CO2
E) a – CO; b – Ca; c – to; d – CO
16 В природе углеводы получаются в результате процесса:
A) Фотосинтеза
B) Дегидрогенизации природных жиров
C) Жизнедеятельности дрожжей
D) Гидратации этилена
E) Взаимодействия этилена и воды
17. Раствор серной кислоты не взаимодействует с
A) барием B) кальцием C) цинком
D) магнием E) медью
18 Химический элемент, в ядре атома которого 33 протона
A) Цинк B) Марганец C) Магний
D) Мышьяк E) Германий
19. Соль образуется в результате реакции между
A) СО2 и Н2
B) Р2О5 и SO3
C) FeO и СаО
D) CuO и HNO3
E) Na2O и H2O
20. Масса меди (г), которая образуется при взаимодействии 0,1 моль железа с 15 г сульфата меди (II)
A) 6,0
B) 8,9
C) 25,6
D) 24,0
E) 6,8
21 Степень окисления азота в ряду NH3 NO N2
A) Сначала повышается, а потом понижается
B) Повышается
C) Сначала понижается, а потом повышается
D) Понижается
E) Не изменяется
22 Сумма всех коэфициентов в уравнении АL+H2SO4-> равна:
А) 2, B) 8, C) 4, D) 5.E) 9
23 Относительная молекулярная масса карбоната кальция равна
A) 40
B) 100
C) 76
D) 96
E) 244.
24. Железный гвоздь не вытесняет металл из раствора его соли:
A) Хлорида олова (II)
B) Хлорида меди (II)
C) Хлорида никеля (II)
D) Хлорида натрия
E) Хлорида свинца (II)
25 Металлическая связь в веществе
A) KCl
B) S
C) HCl
D) P
E) Ba
27. В реакции Zn + H2SO4 (разб) … восстанавливается
A) О-2 B) Zn0 C) S+4 D) H+1 E) S+6
28 Атомы лития и натрия содержат на внешнем электронном уровне число электронов:
A) 1 и 1 B) 3 и 1 C) 1 и 2
D) 2 и 1 E) 1 и 3
29 Количество теплоты, выделяющейся при сгорании 2г угля(термохимическое уравнение реакции С+О2 = СО2+393 кДж, равно: а)24 кДж, B) 65,5 кДж, C) 32,75кДж, D) 393 кДж.E) 55
30. В схеме превращений Al ——+HCL—> AlCl3 —-+NaOH—> Al(OH)3 ——t0—> Al2O3 стадия, на которой сумма всех коэффициентов наибольшая
A) 1
B) 2
C) 3
D) 1, 2
E) 2
Вариант 1
1 Атом состоит из:
A) протонов и нейтронов
B) ядра и вращающихся вокруг него нейтронов
C) протонов и электронов
D) ядра и вращающихся вокруг него электронов
E) нейтронов и электронов
2. К реакциям соединения относится:
A) 2Cu + O2 —> 2CuO
B) Cu(OH)2 + 2HCl —> CuCl2 + 2H2O
C) CuCO3 —> CuO + CO2
D) CuO + H2SO4 —> CuSO4 + H2O
E) CuSO4 + 2NaOH —> Cu(OH)2 + Na2SO4
3 Число электронов в атоме хрома
A) 52
B) 25
C) 24
D) 31
E) 34
4 Реакция, идущая с увеличением объема
A) 2H2 + O2 = 2H2O
B) H2 + Cl2 = 2HCl (возрастает)
C) H2 + CuO = Cu + H2O
D) 2KClO3 = 2KCl + 3O2 (возрастает)
E) N2 + 3H2 = 2NH3 (возрастает)
5. Электронная конфигурация А1
A) …3s2
B) …3s2 3p6
C) …3 s23р1
D) …3s23р4
E) …4s2 4p1
6. Относительная молекулярная масса 95 будет у вещества
A) Al2O3 B) H2O2 C) BaO D) H2O E) MgС12
7. .В схеме превращений
CuO —1—> CuCl2 —2—> Cu(OH)2 —3—> CuSO4 —4—> Cu3(PO4)2
с образованием осадка идет реакция
A) 1, 3
B) 2, 4
C) 3
D) 1
E) 2, 3
8 Сколько атомов углерода содержится в 2 моль:
А) 6,02*1023
В) 1 2,04*1023
С)0,12*1023
Д) 12
Е) 12,04*1020
9.Формула, соответствующая высшему оксиду элементов VI А группы:
A) R2O
B) RO
C) R2O3
D) RO3
E) RO2
10 Ионная связь в веществе А) CuCL2 B) CO2 C) O2 D) CL2 E) HCL
11. Количество теплоты, выделяющейся при сгорании 3,2г метана, равно
160,4 кДж. Тепловой эффект реакции СН4 +2О2 = СО2+ Н2О+Q равен:
A) )+1604кДж B)802 кДж, C) -1604 кДж D) -802 кДж .E) 126 кДж
12. .В реакции обмена не могут участвовать вещества
A) оксиды
B) простые
C) основания
D) сложные
E) кислоты
13. Реакция ионного обмена идет до конца при взаимодействии
A) Хлорида натрия и нитрата лития
B) Нитрата алюминия и хлорида калия
C) Гидроксида калия и гидроксида натрия
D) Сульфата меди и нитрата цинка
E) Соляной кислоты и карбоната натрия
14 Щелочноземельный металл:
A) литий
B) висмут
C) барий
D) молибден
E) алюминий
15. Гетерогенная реакция
A) N2 + O2 = 2NO B) 2H2 (г) + O2 (г) = 2H2O (г)
C) N2 + 3H2 = 2NH3 D) H2 (г) + Cl2 (г) = 2HCl (г)
E) 2Са + О2 = 2СаО
16. Неверно установлено соответствие:
A) Сахароза – кристаллическое вещество, сладкое на вкус
B) Фруктоза – сладкое вещество, без запаха
C) Крахмал – порошок, нерастворимый в холодной воде
D) Глюкоза – кристаллическое вещество, хорошо растворимое в воде
E) Целлюлоза – горючее вещество, хорошо растворимое в воде
17 В 100 г 20%-ного раствора гидроксида натрия содержится воды (в граммах)
A) 10
B) 20
C) 100
D) 80
E) 40
18.Для определения Fe2+ применяют:
A) Сульфат меди
B) Гидроксид натрия
C) Нитрат серебра
D) Хлорид бария
E) Серную кислоту
19 Какой из оксидов образует кислоту H2RO3
А) CO2 В) N2O5 С) SO3 D) CL2O3 E) SO2?
20 . Объем водорода (при н.у.), который образуется при взаимодействии 0,6 моль соляной кислоты с 0,5 моль металлического натрия, равен:
A) 11,2 л
B) 44,8 л
C) 5,6 л
D) 22,4 л
E) 89,6 л
21 Количество вещества в 3,2 г диоксида серы равно
A) 0,05 моль
B) 2 моль
C) 0,1 моль
D) 0,5 моль
E) 1 моль
22. Водный раствор NaOH реагирует с
A) Cu(OH)2
B) HCl
C) KOH
D) MgO
E) NH4OH
23 При окислении происходит
A) Отдача электронов атомом, молекулой или ионом
B) Присоединение электронов
C) Перемещение электронной пары
D) Образование общей электронной пары
E) Завершение внешнего энергетического уровня
24.Нагревание или использование другого вида энергии всегда необходимо для протекания
A) Реакции ионного обмена
B) Любой реакции вообще
C) Эндотермической реакции
D) Окислительно-восстановительной реакции
E) Экзотермической реакции.
25. Число электронных слоёв в атоме элемента, содержащего в ядре 20 протонов:
A) 3 B) 6 C) 4 D) 5.E)7
26. Продукты FeSO4 и Н2О соответствуют взаимодействию реагентов:
A) Fe и H2SO4 (10%)
B) Fe и H2SO4 (96%)
С) FeO и H2SO4
D) Fe2 O 3 и H2SO4
E) FeO и H2SO3
27 При взаимодействии цинка с серной кислотой выделилось 11,2 л. водорода. Вычислите массу цинка.
А) 11,2 г,
В)65 г,
С)32,5 г,
Д)6,5 г.
Е) 6,57 г
28. Сумма всех коэффициентов полного ионного уравнения взаимодействия оксида серы (VI) и гидроксида натрия (образуется средняя соль)
A) 9 B) 8 C) 7 D) 6 E) 5
29. Группа веществ – неэлектролитов
A) H2, H2SiO3
B) MgSO4, HCl
C) KOH, HBr
D) NaOH, HCl
E) HCl, HNO3
30. В схеме превращений
Al —+x—> Al(OH)3 —+y—> AlOHSO4 —+z—> Al(OH)3
Веществами X, Y, Z являются
A) H2O, SO3, H2SO4
B) Al(OH)3, H2SO4, H2O
C) H2O, H2SO4, NaOH
D) NaOH, H2SO4, H2SO3
E)H2O,K2SO4,КОН
4Вариант
1. Электронное строение иона Са2+
A) 1s2 2s2 2p6 3s2 3p1
B) 1s2 2s2 2p6 3s2 3p2
C) 1s2 2s2 2p6 3s2 3p5
D) 1s2 2s2 2p6 3s2 3p3
E) 1s2 2s2 2p6 3s2 3p6
2. Для определения крахмала в пищевых продуктах используют реакцию с
A) Уксусной кислотой
B) Йодом
C) Гидроксидом меди без нагревания
D) Кислородом
E) Водой
3. В реакции обмена не могут участвовать вещества
A) оксиды
B) простые
C) основания
D) сложные
E) кислоты
4. Общая сумма коэффициентов в ионном полном уравнении реакции взаимодействия фосфата натрия и нитрата серебра составляет:
A) 32
B) 30
C) 25
D) 17
E) 12
5. В каком соединении сера имеет степень +4:
А) CuSO4, B) FeS C) H2SO4 D) Li2S E) H2SO3?
6. Реакция ионного обмена, идущая до конца
A) NaOH + HCl → NaCl + H2O
B) NaNO3 + KCl → NaCl + KNO3
C) Zn + 2HCl → ZnCl2 + H2
D) Na2CO3 + 2KOH → K2CO3 + 2NaOH
E) CaO + H2O → Ca(OH)2
7.Кислотный оксид образует
A) Ba
В) Cu
С) S
D) Ca
E) Fe
8 Наименьшую молярную массу имеет оксид
A) BaO
B) SrO
C) CaO
D) BeO
E) MgO
9 Даны вещества: FeCL3 NaNO3 H3PO4 Na2S CaBr2 Сколько веществ реагирует с AgNO3
A) 1 B) 2 C) 3 D) 4 E) 6 ?
14. Степень окисления металлов
10 Соединения с ионной связью:
A) I2, H2
B) C2H5OH, CH3COOH
C) O2, H2O
D) Fe, CuO
E) NaCl, BaCl2
11 Объем порции диоксида серы (н.у.), содержащей атомов кислорода
A) 22,4 л
B) 5,6 л
C) 1,12 л
D) 2,24 л
E) 11,2 л
12.При электролитической диссоциации оснований:
A) образуются катионы металлов и анионы кислотного остатка
B) образуются катионы водорода и гидроксид-ионы
C) образуются катионы водорода и анионы кислотного остатка
D) образуются катионы металла и гидроксид-ионы
E) не образуются ионы
13. В схеме превращений
S —1—> SO2 —2—> SO3 —3—> H2SO4 —4—> K2SO4 —5—> BaSO4
окислительно-восстановительными реакциями будут
A) 1, 5 B) 1, 3 C) 3, 5 D) 1, 2 E) 1, 4
14. Соляная кислота вступает в реакцию с оксидом:
A) кремния (IV)
B) углерода (II)
C) цинка
D) азота (II)
E) серы(1V)
15. При взаимодействии 2 моль сернистого газа с кислородом получено 5,6 л SO3 (н.у.), что составляет от теоретически возможного:
A) 32%
B) 11,5%
C) 17%
D) 36%
E) 12,5%
16 26 протонов в ядре атома элемента
A) Zn
B) Fe
C) Ba
D) Cu
E) Al
17. Оксид серы (IV) будет реагировать со всеми веществами группы
A) H2O, KOH, CaO
B) H2O, H2SO4, K2SO4
C) HCl, CO2, MgO
D) H2O, NaOH, NaNO3
E) H2O, N2, KOH
18. Объем углекислого газа (в н.у.), выделившего при горении 0,1 м3 метана CH4
A) 120 л
B) 100 л
C) 150 л
D) 140 л
E) 130 л
19. Железо будет выделять водород из:
A) Гидроксида натрия (конц.)
B) Раствора серной кислоты
C) Гидроксида аммония
D) Концентрированной азотной кислоты
E) Концентрированной серной кислоты
20. Вещества, растворы или расплавы которых проводят электрический ток
A) Неэлектролиты
B) Изоляторы
C) Ионы
D) Ассоциаты
E) Электролиты
21. Выражать состав нефти одной формулой
A) нельзя, потому что нефть — смесь
B) можно, потому что нефть – горючее вещество
C) можно, потому что нефть – жидкое вещество
D) нельзя, потому что нефть – содержит ароматические углеводороды
E) можно, потому что нефть – сложное вещество
22. Укажите смесь газов, взаимодействующих с водой.
А)СО и СО2,B) СО и NO2, C) CO2 и NO2 , D) CO2 и O2 E) P2O5 и NO
23 Cамый активный металл:
А)Ca В) Cu С) Mg D)Na E) K
24.К щелочам относится:
A Al(OH)3)
B) Be(OH)2
C) Cu(OH)2
D) LiOH
E) Ni(OH)2
25. Сколько теплоты выделится при сжигании 2,4 г магния по термохимическому уравнению: 2Mg+O2→2Mg O+1127 кдж.?
A) 1127 кдж, B) 102 кдж, C) 56,35 кдж, D) 112,70 кдж, E) 28,175 кдж
26 Какой из неметаллов является сильным окислителем :
A) сера. B) кислород, C) азот, D) фтор, E) йод ?
27. При взаимодействии 4,48 л фтора (н.у.) с водой, получается масса О2 равная
A) 1,2 г
B) 2 г
C) 3,2 г
D) 2,4 г
E) 1,6 г
28 Относительная молекулярная масса азота A) 14, B) 28, C) 7, D) 17
E)16
29 Масса 3 моль карбоната кальция равна: A) 230 г, B)200г,
C)330 г, D)300 г. E)410
30 В схеме превращений
CuO —1—> CuCl2 —2—> Cu(OH)2 —3—> CuSO4 —4—> Cu3(PO4)2
с образованием осадка идет реакция
A) 1, 3
B) 2, 4
C) 3
D) 1
E) 2, 3
Ответы теста 5 вариантов за 9 класс по химии:
1 Вариант 1D 2А 3С 4D 5C 6E 7B 8B 9D 10A 11B12B13E 14А 15E 16E17D 18B19E 20A 21A 22B 23A 24C 25C 26C 27D 28B 29A 30C
2 вариант 1B2D3D 4E 5E 6B 7A 8C 9A 10С 11A 12B 13С 14D 15C 16A 17E 18D19D 20A 21A 22E 23B 24D 25E 26E 27D 28A 29B 30A
3 Вариант 1A 2E 3A 4C5D6B 7B 8E 9E 10D 11E 12B 13B 14E 15E 16D 17B 18A 19C 20A 21C 22A 23C 24D 25A 26B 27B 28D 29D 30А
4 Вариант 1E 2B3B 4D 5E 6A7C 8D 9D 10E 11A 12D 13D 14C 15E 16B17A 18B 19 B 20E 21A 22C 23E 24D 25D 26D 27C 28B 29D 30B




























