3 вариант
1. Закончите уравнения реакций:
а) NH3 + O2 (без катализатора) = …
б) KMnO4 = … ;
в) NH4NO2 = … ;
г) РН3 + O2 = … ;
д) NO2 + Н2O + O2 = … .
Какие из этих реакций имеют практическое значение?
2. Осуществите превращения:
Са3(РО4)2 → Р → Na3P → РН3 → Н3РO4 → NH4H2PO4 → Na3PO4 → Ag3PO4.
Укажите условия протекания реакций.
3. Закончите уравнение реакции:
Al + H2SO4 → S + ? + ?.
Расставьте коэффициенты с помощью электронного баланса. Укажите окислитель и восстановитель.
4. Даны вещества: H2S, SO2, O2, СаО. Приведите четыре уравнения реакций между этими веществами.
5. Через 243 г 10%-ного раствора бромоводорода пропустили 4,48 л (н.у.) хлора. Определи массу полученного брома.
Ответы на контрольную работу по химии Неметаллы1 вариант
1.
а) S + O2 = SO2;
б) Si + 2NaOH + Н2O = Na2SiO3 + 2Н2;
в) 2Р + 3Mg = Mg3P2;
г) 4NH3 + 5O2 (в присутствии катализатора) = 4NO + 6Н2О первая стадия производства азотной кислоты;
д) MnO2 + 4НСl(конц.) = MnCl2 + Cl2 + 2Н2O — лабораторный способ получения хлора.
2.
3С + 4Al = Аl4С3;
Аl4С3 + 12Н2O = 4Al(OH)3 + 3СН4;
СН4 + 2O2 = СO2 + 2Н2O;
СO2 + СаО = СаСO3;
СаСO3 + СО2 + Н2O = Са(НСO3)2;
Са(НСO3)2 (t°) = СаСO3 + СO2 + Н2O;
СO2 + С= 2СО.
3.
Сu + 2Н2SO4(конц.) = CuSO4 + SO2 + 2Н2O.
Cu — восстановитель,
S+6 — окислитель.
4.
2HBr + Na2S = 2NaBr + H2S;
Na2S + Cl2 = 2NaCl + S;
4HBr + MnO2 = MnBr2 + Br2 + 2Н2O;
2HBr + Сl2 = 2НСl + Br2.
5. 191,2 г.2 вариант
1.
а) 2SO2 + O2(кат.) = 2SO3;
б) NH3 + HBr = NH4Br;
в) 5O2 + 4Р = 2Р2O5 ;
г) 2H2S + 3O2(избыток) = 2SO2 + 2Н2O;
д) 2KBr + Сl2 = 2КСl + Br2.
2.
N2 + 3Н2(кат.) ⇔ 2NН3;
4NН3 + 5O2(кат.) = 4NO + 6Н2О;
2NO + O2 = 2NO2;
4NO2 + O2 + 2Н2O = 4HNO3;
2HNO3 + CuO = Cu(NO3)2 + Н2O;
Cu(NO3)2 + 2NaOH = Cu(OH)2 + 2NaNO3;
NаNО3(кристаллич.) + Н2SO4(конц.) = NaHSO4 + HNO3.
3.
3Cu + 8НNO3(разб.) = 3Cu(NO3)2 + 2NO + 4Н2O.
Cu — восстановитель,
N+5 — окислитель.
4.
H2SO4 + CuO = CuSO4 + Н2O;
H2SO4 + 2NaOH = Na2SO4 + 2Н2O;
2CuO + Si = SiO2 + 2Cu;
Si + Н2O + 2NaOH = Na2SiO3 + 2Н2.
5. 25 г.3 вариант
1.
а) 4NH3 + 3O2 (без катализатора) = 2N2 + 6Н2O;
б) 2KMnO4 = K2MnO4 + MnO2 + O2;
в) NH4NO2 (t°) = N2 + 2Н2O;
г) РН3 + 2O2 = Н3РO4;
д) 4NO2 + 2Н2O + O2 = 4HNO3.
2.
Са3(РО4)2 + 5С + 3SiO2 (прокаливание) = 2Р + 3CaSiO3 + 5СО;
Р + 3Na = Na3P;
Na3P + 3НСl = 3NaCl + РН3;
РН3 + 2O2 = Н3РО4;
Н3РО4(избыток) + NH3 = NH4H2PO4;
NH4H2PO4 + 3NаОН(избыток) = Nа3РО4 + NН3 + 3Н2О;
Na3PO4 + 3AgNO3 = Ag3PO4 + 3NaNO3.
3.
2Al + 4H2SO4 = S + Al2(SO4)3 + 4Н2.
Аl — восстановитель;
S+6 — окислитель.
4.
2H2S + SO2 = 3S + 2Н2O;
2SO2 + O2(кат.) ⇔ 2SO3;
2H2S + 3O2(избыток) = 2SO2 + 2Н2O или
2H2S + O2(недостаток) = 2S + 2Н2О;
SO2 + СаО = СаSO3.
5. 24 г.
Список вопросов теста
Вопрос 2
В ходе химической реакции количество исходного вещества (реагента), которое еще не вступило в реакцию, со временем постепенно уменьшается. На рисунке эта зависимость представлена графиком. На оси абсцисс откладывается время в минутах, прошедшее с момента начала реакции, на оси ординат – масса оставшегося реагента, который еще не вступил в реакцию (в граммах). Определите по графику, сколько граммов реагента вступило в реакцию за три минуты?
Вопрос 3
На клетчатой бумаге с размером клетки 1 см на 1 см изображен параллелограмм. Найти его площадь. Ответ дать в квадратных сантиметрах
Вопрос 4
На конференцию приехали 4 ученых из Германии, 4 из Румынии и 8 из Дании. Каждый из них делает на конференции один доклад. Порядок докладов определяется жеребьёвкой. Найдите вероятность того, что седьмым окажется доклад ученого из Дании.
Вопрос 6
В прямоугольном треугольнике один из углов равен 15 градусов, найдите угол между биссектрисой и медианой проведенной из прямого угла. Ответ дайте в градусах.
Вопрос 7
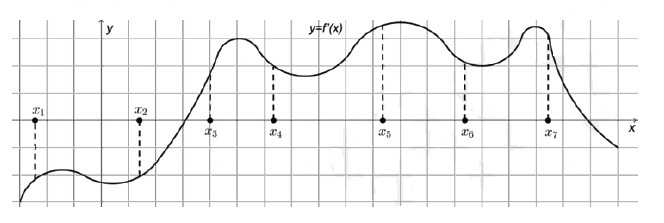
На рисунке изображена производная функции f `(x). На оси абцисс отмечены семь точек. В скольких из этих точек функция возрастает?
Водолазный колокол, содержащий 2 моля воздуха при давлении p1=1,75 атмосферы, медленно опускают на дно водоeма. При этом происходит изотермическое сжатие воздуха до конечного давления p2.Работа, совершаемая водой при сжатии воздуха, определяется выражением \(A=\alpha\nu T\log_2\frac\) (Дж), где \(\alpha=13,3\ \frac\) – постоянная, а – температура воздуха. Какое давление p2 (в атм) будет иметь воздух, если при сжатии воздуха была совершена работа в 15 960 Дж?
Велосипедист выехал с постоянной скоростью из города А в город В, расстояние между которыми равно 128 км. На следующий день он отправился обратно со скоростью, на 8 км/ч больше прежней. По дороге он сделал остановку на 8 часов. В результате он затратил на обратный путь столько же времени, сколько на путь из А в В. Найдите скорость велосипедиста на пути из B в A. Ответ дайте в км/ч.
На клетчатой бумаге с размером клетки 1 см на 1 см изображен параллелограмм. Найти его площадь. Ответ дать в квадратных сантиметрах
На рисунке изображена производная функции f `(x). На оси абцисс отмечены семь точек. В скольких из этих точек функция возрастает?
Определите по графику, сколько граммов реагента вступило в реакцию за три минуты.
23.09.2019 8:30:59
2019-09-23 08:30:59





























