Периодический закон
К середине XIX века учёные располагали множеством сведений о физических и химических свойствах разных элементов и их соединений. Появилась необходимость упорядочить эти знания и представить их в наглядном виде. Исследователи из разных стран пытались создать классификацию, объединяя элементы по сходству состава и свойств веществ, которые они образуют. Однако ни одна из предложенных систем не охватывала все известные элементы.
Пытался решить эту задачу и молодой русский профессор Д.И. Менделеев. Он собирал и классифицировал информацию о свойствах элементов и их соединений, а затем уточнял её в ходе многочисленных экспериментов. Собрав данные, Дмитрий Иванович записал сведения о каждом элементе на карточки, раскладывал их на столе и многократно перемещал, пытаясь выстроить логическую систему. Долгие научные изыскания привели его к выводу, что свойства элементов и их соединений изменяются с возрастанием атомной массы, однако не монотонно, а периодически.
Так был открыт периодический закон, который учёный сформулировал следующим образом: «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса».
Своё открытие Менделеев совершил почти за 30 лет до того, как учёным удалось понять структуру атома. Открытия в области атомной физики позволили установить, что свойства элементов определяются не атомной массой, а зависят от количества электронов, содержащихся в нём. Поэтому современная формулировка закона звучит так:
Свойства химических элементов, а также формы и свойства образуемых ими веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов.
Этот принцип Менделеев проиллюстрировал в таблице, в которой были представлены все 63 известных на тот момент химических элемента. При её создании учёный предпринял ряд весьма смелых шагов.
<<Форма демодоступа>>
Во-первых, многочисленные эксперименты позволили Менделееву сделать вывод, что атомные массы некоторых элементов ранее были вычислены неправильно, и он изменил их в соответствии со своей системой.
Во-вторых, в таблице были оставлены места для новых элементов, открытие которых учёный предсказал, подробно описав их свойства.

Мировое научное сообщество поначалу скептически отнеслось к открытию русского химика. Однако вскоре были открыты предсказанные им химические элементы: галлий, скандий и германий. Это разрушило сомнения в правильности системы Менделеева, которая навсегда изменила науку. Там, где раньше учёному требовалось провести ряд сложнейших (и даже не всегда возможных в реальности) опытов — теперь стало достаточно одного взгляда в таблицу.
Теперь расскажем, как устроена Периодическая таблица элементов Менделеева и как ею пользоваться.
Атомный номер
Атомный номер элемента в таблице Менделеева представляет собой порядковый номер элемента в периодической системе химических элементов. Он указывает на количество протонов в ядре атома данного элемента. Атомный номер используется для идентификации и классификации элементов в таблице Менделеева.
Самым тяжелым химическим элементом в таблице Менделеева является оганиессон (Og), атомный номер которого равен 118. Оганиессон был синтезирован в 2002 году и является элементом с наибольшим известным атомным номером. Он относится к группе благородных газов и является одним из самых редких и нестабильных элементов.
Атомный номер элемента важен для определения его положения в таблице Менделеева и для понимания его химических свойств. Чем больше атомный номер, тем тяжелее элемент и тем больше протонов он содержит в ядре своего атома. Атомный номер также определяет расположение элемента в периодической системе, его химическую активность и связан с его электронной конфигурацией.
Таблица Менделеева представляет собой систематическую организацию химических элементов в форме сетки или таблицы. Она включает в себя 118 различных химических элементов, упорядоченных по возрастанию атомного номера. В таблице Менделеева элементы разделены на ряды, группы и блоки в зависимости от их электронной конфигурации и химических свойств.
Атомный номер является важным понятием в химии и является основой для понимания периодического закона Менделеева и других закономерностей химических элементов. Он позволяет классифицировать элементы, предсказывать их свойства и строить соответствующие химические реакции и уравнения.
Эволюционная теория происхождения жизни на Земле
Эволюцией можно назвать необратимые процессы исторических изменений жизни. Данная теория построена на четырех принципах:
- Избыточное потомство. Все биологические виды живых организмов очень быстро размножаются. Однако далеко не все потомство выживает, поэтому все популяции находятся в стабильности.
- Борьба за выживание также способствует контролю численности популяции.
- Наличие несущественных различий. Так как все живые особи индивидуальны, одни виды имеют больше шансов на выживание, в то время как другие меньше.
- Наследственность. Наследственная информация передается через родителей к потомству. Так вот, благодаря некоторым наследственным различиям, некоторые особи больше способны к выживанию, чем другие.
Почему нужно знать, как устроен этот мир?
Первый вопрос, который вероятно возникает при переходе на эту статью, это вопрос: «А зачем вообще знать, из чего всё состоит, и какое мне дело до того, как этот мир устроен?». Для разрешения так скоро нарисовавшегося вопроса давайте поговорим о воде, ведь вы же о ней зашли почитать?
Итак, если ты заходишь в воду, то тебе нужно знать несколько простых вещей: по воде можно плавать, под водой дышать нельзя, следовательно, если не умеешь плавать, то заходить слишком далеко не стоит. Каждый, кто заходит в воду, знает об этих базовых правилах, потому как это даёт возможность взаимодействовать с водой без неприятных последствий.
Теперь перенесёмся ближе к теме. Иметь дела с этим миром можно только тогда, когда тебе ясно, как он работает
, как он устроен и из чего всё состоит. Остановите человека, спросите у него, как устроен этот мир, и он подвиснет от вашего вопроса. Мы и понятия не имеем, как здесь всё устроено и что вообще со всем этим делать. Потому многие из нас остаются несчастны и живут в полнейшей неопределённости. Давайте изменим это!
Таблица оксидов (2 часть):
| 36 | Криптон | Kr | нет |
| 37 | Рубидий | Rb | Rb2O (оксид рубидия, окись рубидия) |
| 38 | Стронций | Sr | SrO (оксид стронция, окись стронция) |
| 39 | Иттрий | Y | Y2O3 (оксид иттрия, сесквиоксид иттрия) |
| 40 | Цирконий | Zr | ZrO2 (оксид циркония (IV), оксид циркония, диоксид циркония) |
| 41 | Ниобий | Nb | NbO (оксид ниобия (II), окись ниобия),
Nb2O3 (оксид ниобия (III), окись ниобия), NbO2 (оксид ниобия (IV), окись ниобия), Nb2O5 (оксид ниобия (V), окись ниобия) |
| 42 | Молибден | Mo | Mo2O3 (оксид молибдена (III), окись молибдена),
MoO2 (оксид молибдена (IV), окись молибдена), Mo2O5 (оксид молибдена (V), окись молибдена), MoO3 (оксид молибдена (VI), триоксид молибдена, триоксомолибден, молибдит) |
| 43 | Технеций | Tc | TcO2 (оксид технеция (IV), окись технеция (IV)),
Tc2O7 (оксид технеция (VII), окись технеция (VII)) |
| 44 | Рутений | Ru | Ru2O3 (оксид рутения (III), окись рутения (III), сесквиоксид рутения),
RuO2 (оксид рутения(IV), окись рутения (IV)), RuO4 (оксид рутения(VIII), тетраоксид рутения) |
| 45 | Родий | Rh | RhO (оксид родия (II), окисел родия),
Rh2O3 (оксид родия (III), сесквиоксид родия), RhO2 (оксид родия (IV), окисел родия) |
| 46 | Палладий | Pd | PdO (оксид палладия (II), окись палладия),
Pd2O3•n H2O (оксид палладия (III), окисел палладия), PdO2 (оксид палладия (IV), окисел палладия) |
| 47 | Серебро | Ag |
Ag2O (оксид серебра (I)),
Ag+1Ag+3O2 или Ag2O2 (оксид серебра (I,III), оксид серебра (III)-серебра (I), монооксид серебра, диоксид дисеребра) |
| 48 | Кадмий | Cd |
Cd2O (оксид кадмия (I)),
CdO (оксид кадмия (II)) |
| 49 | Индий | In | In2O (оксид индия (I), окись индия (I), гемиоксид индия, закись индия),
InO (оксид индия (II), окись индия (II)), In2O3 (оксид индия (III)) |
| 50 | Олово | Sn |
SnO (оксид олова (I), монооксид олова, олово окись (II), олово закись, олово одноокись),
SnO2 (оксид олова (IV), окись олова, двуокись олова, диоксид олова, касситерит), Sn3O4 |
| 51 | Сурьма | Sb | Sb2O3 (оксид сурьмы (III), сесквиоксид сурьмы, сурьмянистый ангидрид),
Sb2O5 (оксид сурьмы (V), пятиокись сурьмы, сурмяный ангидрид), Sb2O4 или SbIIISbVO4 (тетраоксид сурьмы, диоксид сурьмы) |
| 52 | Теллур | Te | TeO2 (оксид теллура (IV), диоксид теллура, теллурит, двуокись теллура, ангидрид теллуристой кислоты),
TeO3 (оксид теллура (VI), триоксид теллура, трёхокись теллура, ангидрид теллуровой кислоты), Te2O5, Te4O9 |
| 53 | Йод | I | I+12O (монооксид дийода),
I+2O (монооксид йода), I+4O2 (диоксид йода), I+3, +52O4 или I+3O(I+5O3) или (I+3, +5O2)2 (тетраоксид дийода, иодноватокислый йод), I+52O5 или O(IO2)2(оксид йода (V), пентаоксид дийода, иодноватый ангидрид), I+3, +54O9 или I+3(I+5O3)3 или I+3(OI+5O2)3 (иодат йода (III), иодноватокислый йод, нонаоксид тетрайода) |
| 54 | Ксенон | Xe | XeO2 (оксид ксенона (IV), диоксид ксенона),
XeO3 (триоксид ксенона), XeO4 (тетраоксид ксенона) |
| 55 | Цезий | Cs | Cs2O (оксид цезия, окись цезия) |
| 56 | Барий | Ba | BaO (оксид бария, окись бария, безводный барит) |
| 57 | Лантан | La | La2O3 (оксид лантана (III), сесквиоксид лантана) |
| 58 | Церий | Ce | Ce2O3 (оксид церия (III)),
CeO2 (оксид церия (IV), диоксид церия, двуокись церия) |
| 59 | Празеодим | Pr | PrO (оксид празеодима (II), монооксид празеодима),
Pr2O3 (оксид празеодима (III), сесквиоксид празеодима), PrO2 (оксид празеодима (IV), окись празеодима), Pr6O11 (оксид празеодима (III, IV), ундекаоксид гексапразеодима) |
| 60 | Неодим | Nd | NdO (оксид неодима (II), окисел неодима),
Nd2O3 (оксид неодима (III), сесквиоксид неодима) |
| 61 | Прометий | Pm | Pm2O3 (оксид прометия (III), сесквиоксид прометия) |
| 62 | Самарий | Sm | SmO (оксид самария (II), монооксид самария, окись самария),
Sm2O3 (оксид самария (III), сесквиоксид самария, окись самария) |
| 63 | Европий | Eu | EuO (оксид европия (II), монооксид европия, окись европия),
Eu3O4 или или EuO•Eu2O3 (оксид европия (II,III)), Eu2O3 (оксид европия (III)) |
| 64 | Гадолиний | Gd | Gd2O3 (оксид гадолиния (III), окись гадолиния) |
| 65 | Тербий | Tb | Tb2O3 (оксид тербия (III), трехокись тербия, триоксид тербия),
Tb4O7 (оксид тербия (III, IV), гептаоксид тетратербия), TbO2 (оксид тербия (IV), диоксид тербия), Tb6O11 |
| 66 | Диспрозий | Dy | Dy2O3 (оксид диспрозия (III), окись диспрозия, триоксид диспрозия) |
| 67 | Гольмий | Ho | Ho2O3 (оксид гольмия (III), окись гольмия) |
| 68 | Эрбий | Er | Er2O3 (оксид эрбия (III), окись эрбия, триоксид эрбия) |
| 69 | Тулий | Tm | Tm2O3 (оксид тулия (III), сесквиоксид тулия) |
| 70 | Иттербий | Yb | Yb2O3 (оксид иттербия (III), окись иттербия , сесквиоксид иттербия) |
Фазовый оптимум
Твердые кристаллические тела имеют хорошо развитую упорядоченность, структуру и стабильность. Но способность к реакциям низкая благодаря незначительной подвижности элементов кристаллической решетки. Соединения в газообразном состоянии могут быстро реагировать с другими веществами и отличаются лабильностью. Но они характеризуются хаотичностью на макроуровне и неспособностью образовывать сколько-нибудь упорядоченные структуры. Только жидкость имеет оптимальное сочетание устойчивости и лабильности, которое необходимо для дальнейшей самоорганизации химических элементов и молекул в более сложные системы.
Отсюда следует, что для химической эволюции планета должна иметь достаточное гравитационное поле, которое могло содержать гидросферу. Для этого у нее должна быть определенная масса и орбита, приближенная к круговой. Если масса планеты великовата, то происходят интенсивные ядерные реакции, а температура сохраняется на высоком уровне, что препятствует образованию устойчивых сложных химических систем. Малая масса связана с небольшой силой тяжести и невозможностью удержания даже атмосферы. Кроме того, круговая орбита обеспечивает оптимум радиации от центрального светила и определенную равномерность протекания реакций в химических системах. Таким требованиям отвечает очень мало планет в нашей Галактике.
Наличие воды на Земле — это невероятное космическое везение. Сам комплекс из двух атомов водорода и одного атома кислорода вызвал появление уникальной химической системы, существенные особенности которой нельзя свести к простой сумме характеристик двух газов, входящих в ее состав. Уникальность проявляется в том, что вода как система приобретает такие принципиально новые свойства:
- это универсальный растворитель, способный превращать кислоты, щелочи и соли в ионы с повышенной реакционной способностью;
- удельная теплоемкость воды выше, чем во многих других веществ, благодаря чему океаны могут поглощать и отдавать огромное количество тепла, выравнивая климат на планете;
- поверхностное натяжение воды больше, чем у любого другого вещества (кроме ртути), что способствует перемещению водных растворов различных химических веществ по капиллярам растительных сосудов;
- молекулы воды определенным образом упорядочиваются вокруг макромолекул, облегчая их функционирования и тому подобное.
Все вышеизложенное позволяет признать, что первичная Земля была уникальной в том отношении, что условия на ней (достаточно разнообразен газовый состав атмосферы, извержения вулканов, интенсивные процессы выветривания и размывания и т.д.) способствовали формированию постоянных контактов трех фаз (твердой, жидкой и газовой), что существенно активизировало химические процессы. Такое чрезвычайно уместное объединение в единую систему трех различных фаз, сохранялось в течение многих миллионов лет, и получило название сферы равновесия.
Типы круговоротов веществ в биосфере
На Земле различают два типа круговорота веществ: большой, или геологический, и малый, или биологический. Большой круговорот часто называют круговоротом воды.
Большим круговоротом, или геологическим, веществ называют обмен веществ между сушей и океаном, совершаемый водой. В настоящее время сухопутные части материков располагаются значительно выше океанов, поэтому океанические воды, выпавшие в виде осадков на сушу, быстро или медленно стекают в океан. Однако вода не просто стекает вниз, в океан, проходя сквозь толщу литосферы (педосферы), она свершает при этом большую работу: растворяет минералы, разрушает горные породы, переносит растворенные вещества и взвешенные частицы в океан. Таким путем в литосфере происходит постоянное разрушение и вынос веществ, а в океане идет их накопление в виде осадков (осадочных пород). Но земная кора находится в постоянном горизонтальном и вертикальном движении: благодаря движению материковых плит одни участки опускаются и заливаются водами морей и океанов, а другие поднимаются. В результате те вещества, что накопились в океане, оказываются на суше, а те, что образовывали поверхность континентов, — на дне моря. Спустя время (десятки и сотни тысяч лет) движение земной коры может пойти в обратном направлении и, следовательно, один цикл большого глобального круговорота будет завершен и начнется другой его цикл.
Малым, или биологическим, круговоротом веществ называют обмен химическими элементами (атомами) между живыми организмами и косными компонентами биосферы: атмосферой, гидросферой и литосферой.
Напомним, что биологический круговорот характеризуется структурой из четырех обязательных взаимосвязанных компонентов: 1) запаса химических веществ и энергии; 2) продуцентов; 3) консументов; 4) редуцентов.
Организмы вовлекают атомы биогенных веществ из косной части биосферы в свои тела, где они вступают в различные биохимические реакции, а затем выделяют их во внешнюю среду в виде продуктов жизнедеятельности или распада. В итоге все живое население биосферы и окружающая среда, откуда организмы черпают средства для жизни и куда выделяют продукты своей жизнедеятельности, создают целостное, тесно связанное, взаимодействующее единство — экосистему. Организованная взаимосвязью организмов в глобальную экосистему, жизнь на планете продолжается уже миллионы лет.
Изменения массы живого вещества, его структуры, химизма определяют изменение характера биологического круговорота. Восходящую часть образует взаимодействие растений с окружающей абиотической средой, итогом чего является создание первичной продукции, а нисходящую — все звенья экосистемы, обеспечивающие преобразование синтезированной продукции до неорганических веществ. Устойчивой оказывается та экосистема, в которой восходящий поток круговорота уравновешивается нисходящим потоком.
Геологический и биологический круговороты тесно взаимодействуют между собой, порой сливаясь воедино. Однако структурно и функционально они существенно отличатся друг от друга. Биологический круговорот отличается от геологического следующими особенностями:
- причиной и движущей силой биологического круговорота является различие в характере питания продуцентов и редуцентов, а геологического — круговорот воды между океаном и сушей;
- в биологическом круговороте участвуют только биогенные элементы, тогда как в геологическом — все химические элементы, находящиеся в земной коре;
- продолжительность циклов химических элементов в биологическом круговороте кратковременна — год, несколько лет, десятки или сотни лет, а продолжительность цикла в геологическом круговороте равна десяткам и сотням тысяч лет.
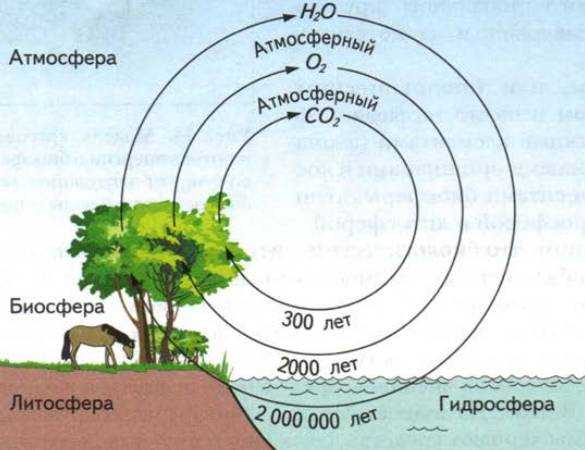
Скорости круговорота некоторых биогенных элементов
Химические явления. Химическая реакция.
Если при физических явлениях вещества, как правило, лишь изменяют агрегатное состояние, то при химических явлениях происходит превращение одних веществ в другие вещества. Приведем несколько простых примеров: горение спички сопровождается обугливанием древесины и выделением газообразных веществ, то есть, происходит необратимое превращение древесины в другие вещества. Другой пример: со временем бронзовые скульптуры покрываются налетом зеленого цвета. Дело в том, что в состав бронзы входит медь. Этот металл медленно взаимодействует с кислородом, углекислым газом и влагой воздуха, в результате на поверхности скульптуры образуются новые вещества зеленого цвета Химические явления – явления превращений одних веществ в другие Процесс взаимодействия веществ с образованием новых веществ называют химической реакцией. Химические реакции происходят повсеместно вокруг нас. Химические реакции происходят и в нас самих. В нашем организме непрерывно происходят превращения множества веществ, вещества реагируют друг с другом, образуя продукты реакции. Таким образом, в химической реакции всегда есть реагирующие вещества, и вещества, образовавшиеся в результате реакции.
- Химическая реакция – процесс взаимодействия веществ, в результате которого образуются новые вещества с новыми свойствами
- Реагенты – вещества, вступающие в химическую реакцию
- Продукты – вещества, образовавшиеся в результате химической реакции
Химическая реакция изображается в общем виде схемой реакции РЕАГЕНТЫ -> ПРОДУКТЫ
- реагенты – исходные вещества, взятые для проведения реакции;
- продукты – новые вещества, образовавшиеся в результате протекания реакции.
Любые химические явления (реакции) сопровождаются определенными признаками, при помощи которых химические явления можно отличить от физических. К таким признакам можно отнести изменение окраски веществ, выделение газа, образование осадка, выделение тепла, излучение света.
Многие химические реакции сопровождаются выделением энергии в виде тепла и света. Как правило, такими явлениями сопровождаются реакции горения. В реакциях горения на воздухе вещества реагируют с кислородом, содержащимся в воздухе. Так, например, металл магний вспыхивает и горит на воздухе ярким слепящим пламенем. Именно поэтому вспышку магния использовали при создании фотографий в первой половине ХХ века. В некоторых случаях возможно выделение энергии в виде света, но без выделения тепла. Один из видов тихоокеанского планктона способен испускать ярко-голубой свет, хорошо заметный в темноте. Выделение энергии в виде света – результат химической реакции, которая протекает в организмах данного вида планктона.
Итог статьи:
- Существуют две большие группы веществ: вещества природного и искусственного происхождения
- В обычных условиях вещества могут находиться в трех агрегатных состояниях
- Свойства веществ, которые определяют измерениями или визуально при отсутствии превращения одних веществ в другие, называют физическими
- Кристаллы – твердые тела, имеющие форму правильных многогранников
- Аморфные вещества – вещества, не имеющие кристаллического строение
- Химические явления – явления превращений одних веществ в другие
- Реагенты – вещества, вступающие в химическую реакцию
- Продукты – вещества, образующиеся в результате химической реакции
- Химические реакции могут сопровождаться выделением газа, осадка, тепла, света; изменением окраски веществ
- Горение – сложный физико-химический процесс превращения исходных веществ в продукты сгорания в ходе химической реакции, сопровождающийся интенсивным выделением тепла и света (пламени)
Оксиды. Классификация, свойства, получение, применение
Оксиды — это неорганические соединения, состоящие из двух химических элементов, одним из которых является кислород в степени окисления -2. Единственным элементом, не образующим оксид, является фтор, который в соединении с кислородом образует фторид кислорода. Это связано с тем, что фтор является более электроотрицательным элементом, чем кислород.
Данный класс соединений является очень распространенным. Каждый день человек встречается с разнообразными оксидами в повседневной жизни. Вода, песок, выдыхаемый нами углекислый газ, выхлопы автомобилей, ржавчина — все это примеры оксидов.
Классификация оксидов
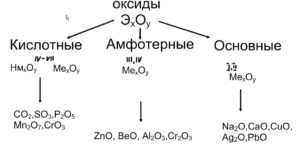
Все оксиды, по способности образовать соли, можно разделить на две группы:
- Солеобразующие оксиды (CO2, N2O5,Na2O, SO3 и т. д.)
- Несолеобразующие оксиды(CO, N2O,SiO, NO и т. д.)
В свою очередь, солеобразующие оксиды подразделяют на 3 группы:
- Основные оксиды — (Оксиды металлов — Na2O, CaO, CuO и т д)
- Кислотные оксиды — (Оксиды неметаллов, а так же оксиды металлов в степени окисления V-VII — Mn2O7,CO2, N2O5, SO2, SO3 и т д)
- Амфотерные оксиды (Оксиды металлов со степенью окисления III-IV а так же ZnO, BeO, SnO, PbO)
Данная классификация основана на проявлении оксидами определенных химических свойств. Так, основным оксидам соответствуют основания, а кислотным оксидам — кислоты.
Кислотные оксиды реагируют с основными оксидами с образованием соответствующей соли, как если бы реагировали основание и кислота, соответствующие данным оксидам:Аналогично, амфотерным оксидам соответствуют амфотерные основания, которые могут проявлять как кислотные, так и основные свойства:Химические элементы проявляющие разную степень окисления, могут образовывать различные оксиды. Чтобы как то различать оксиды таких элементов, после названия оксиды, в скобках указывается валентность.
CO2 – оксид углерода (IV)
N2O3 – оксид азота (III)
Физические свойства оксидов
Оксиды весьма разнообразны по своим физическим свойствам. Они могут быть как жидкостями (Н2О), так и газами (СО2, SO3) или твёрдыми веществами (Al2O3, Fe2O3). Приэтом оснОвные оксиды, как правило, твёрдые вещества. Окраску оксиды также имеют самую разнообразную — от бесцветной (Н2О, СО) и белой (ZnO, TiO2) до зелёной (Cr2O3) и даже чёрной (CuO).
Химические свойства оксидов
Некоторые оксиды реагируют с водой с образованием соответствующих гидроксидов (оснований):Основные оксиды реагируют с кислотными оксидами с образованием солей:Аналогично реагируют и с кислотами, но с выделением воды:Оксиды металлов, менее активных чем алюминий, могут восстанавливаться до металлов:
Кислотные оксиды в реакции с водой образуют кислоты:Некоторые оксиды (например оксид кремния SiO2) не взаимодействуют с водой, поэтому кислоты получают другими путями.
Кислотные оксиды взаимодействуют с основными оксидами, образую соли:Таким же образом, с образование солей, кислотные оксиды реагируют с основаниями:Если данному оксиду соответствует многоосновная кислота, то так же может образоваться кислая соль:Нелетучие кислотные оксиды могут замещать в солях летучие оксиды:
Как уже говорилось ранее, амфотерные оксиды, в зависимости от условий, могут проявлять как кислотные, так и основные свойства. Так они выступают в качестве основных оксидов в реакциях с кислотами или кислотными оксидами, с образованием солей: И в реакциях с основаниями или основными оксидами проявляют кислотные свойства:
Получение оксидов
Оксиды можно получить самыми разнообразными способами, мы приведем основные из них.
Большинство оксидов можно получить непосредственным взаимодействием кислорода с химических элементом: При обжиге или горении различных бинарных соединений:Термическое разложение солей, кислот и оснований :Взаимодействие некоторых металлов с водой:
Применение оксидов
Оксиды крайне распространены по всему земному шару и находят применение как в быту, так и в промышленности. Самый важный оксид — оксид водорода, вода — сделал возможной жизнь на Земле. Оксид серы SO3 используют для получения серной кислоты, а также для обработки пищевых продуктов — так увеличивают срок хранения, например, фруктов.
Оксиды железа используют для получения красок, производства электродов, хотя больше всего оксидов железа восстанавливают до металлического железа в металлургии.
Оксид кальция, также известный как негашеная известь, применяют в строительстве. Оксиды цинка и титана имеют белый цвет и нерастворимы в воде, потому стали хорошим материалом для производства красок — белил.
Оксид углерода CO2, который выделяют при дыхании все живые организмы, используется для пожаротушения, а также, в виде сухого льда, для охлаждения чего-либо.
Как они были сформированы?

Оксиды образуются, когда элементы реагируют с кислородом. Эта реакция может происходить просто при контакте с богатой кислородом атмосферой или при нагревании (например, пламенем зажигалки). То есть, когда объект горит, он вступает в реакцию с кислородом (если он присутствует в воздухе).
Например, если поместить кусочек фосфора в пламя, он сгорит и образует соответствующий оксид:
В этом процессе некоторые твердые вещества, такие как кальций, могут гореть ярким, светящимся пламенем.
Другим примером является сжигание древесины или других органических веществ, содержащих углерод:
Однако в отсутствие кислорода вместо СО образуется СО.2:
Обратите внимание, как соотношение C/O используется для описания различных оксидов





















