Альдегиды и кетоны
Альдегидами называют производные углеводородов, у которых при первичном атоме углерода два атома водорода заменены на один атом кислорода, т.е. производные углеводородов в структуре которых имеется альдегидная группа –СН=О. Общую формулу альдегидов можно записать как R-CH=O. Например:
| этаналь | метаналь |
Кетонами называют производные углеводородов, у которых при вторичном атоме углерода два атома водорода заменены на атом кислорода, т.е. соединения, в структуре которых есть карбонильная группа –C(O)-.
Общая формула кетонов может быть записана как R-C(O)-R’. При этом радикалы R, R’ могут быть как одинаковыми, так и разными.
Например:
| пропанон | бутанон |
Как можно заметить, альдегиды и кетоны весьма схожи по строению, однако их все-таки их различают как классы, поскольку они имеют существенные различия в химических свойствах.
Общая молекулярная формула предельных кетонов и альдегидов одинакова и имеет вид CnH2nO
Особенности строения органических соединений
Органическая химия изучает строение молекул и свойства соединений углерода, кроме самых простых (угольная и синильная кислоты и их соли).
В состав неорганических соединений могут входить любые из 114 известных в настоящее время химических элементов. Сейчас известно более 0,5 млн неорганических веществ.
В состав органических молекул обычно входят атомы 6 химических элементов: C, H, O, N, P, S. И тем не менее в настоящее время известно более 20 миллионов органических соединений.
Почему органических веществ так много?
Поскольку в состав любого органического соединения входит атом углерода, попробуем найти ответ на этот вопрос, рассмотрев особенности строения атома углерода.
Углерод — химический элемент 2-го периода, IV группы Периодической системы химических элементов Менделеева, следовательно, строение его атома можно изобразить так:
![]()
Таким образом, на внешнем уровне атома углерода находится четыре электрона. Являясь неметаллом, атом углерода может и отдавать четыре электрона, и принимать до завершения внешнего уровня также четыре электрона. Поэтому:
- атом углерода в органических соединениях всегда четырёхвалентен;
- атомы углерода способны соединяться друг с другом, образуя цепи различной длины и строения;
- атомы углерода соединяются друг с другом и с другими атомами при помощи ковалентной связи, которую в формуле обозначают чёрточкой; так как валентность атома углерода равна четырём, — общее число чёрточек (химических связей) у одного атома углерода тоже равно четырём.
В состав углеродных цепочек может входить разное число атомов углерода: от одного до нескольких тысяч. Кроме того, цепочки могут иметь разное строение:

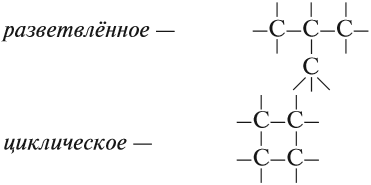
Между атомами углерода могут возникать химические связи разного типа:
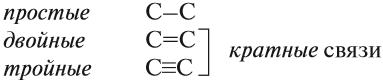
Поэтому всего лишь четыре (!) атома углерода могут образовать более 10 соединений разного строения, даже если в состав таких соединений будут входить только атомы углерода и водорода. Эти соединения будут иметь, например, следующие «углеродные скелеты»:
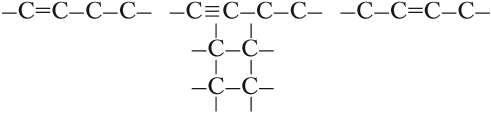
и другие.
Задание 17.1. Попробуйте составить сами 2–3 цепочки атомов углерода иного строения из четырёх атомов углерода.
Выводы
Способность атомов углерода образовывать УГЛЕРОДНЫЕ ЦЕПИ разного состава и строения — главная причина многообразия органических соединений.

Спирты и фенолы
Спирты – производные углеводородов, один или несколько атомов водорода в которых заменены на гидроксильную группу -OH. Спирты с одной гидроксильной группой называют одноатомными, с двумя – двухатомными, с тремя трехатомными и т.д. Например:
Спирты с двумя и более гидроксильными группами называют также многоатомными спиртами. Общая формула предельных одноатомных спиртов CnH2n+1OH или CnH2n+2O. Общая формула предельных многоатомных спиртов CnH2n+2Ox , где x – атомность спирта.
Спирты могут быть и ароматическими. Например:
бензиловый спирт
Общая формула таких одноатомных ароматических спиртов CnH2n-6O.
Однако, следует четко понимать, что производные ароматических углеводородов, в которых на гидроксильные группы заменены один или несколько атомов водорода при ароматическом ядре не относятся к спиртам. Их относят к классу фенолы. Например, это данное соединение является спиртом:
А это представляет собой фенол:
Причина, по которой фенолы не относят к спиртам, кроется в их специфических химических свойствах, сильно отличающих их от спиртов. Как легко заметить, однотомные фенолы изомерны одноатомным ароматическим спиртам, т.е. тоже имеют общую молекулярную формулу CnH2n-6O.
Сложные эфиры в природе и технике
Сложные эфиры широко распространены в природе, находят применение в технике и различных отраслях промышленности. Они являются хорошими растворителями органических веществ, их плотность меньше плотности воды, и они практически не растворяются в ней. Так, сложные эфиры с относительно небольшой молекулярной массой представляют собой легко воспламеняющиеся жидкости с невысокими температурами кипения, имеют запахи различных фруктов. Их применяют в качестве растворителей лаков и красок, ароматизаторов изделий пищевой промышленности. Например, метиловый эфир масляной кислоты имеет запах яблок, этиловый эфир этой кислоты — запах ананасов, изобутиловый эфир уксусной кислоты — запах бананов:
Амины
Аминами называют производные аммиака, в которых один, два или все три атома водорода замещены на углеводородный радикал.
Амины, в которых только один атом водорода замещен на углеводородный радикал, т.е. имеющие общую формулу R-NH2, называют первичными аминами.
Амины, в которых два атома водорода замещены на углеводородные радикалы, называют вторичными аминами. Формулу вторичного амина можно записать как R-NH-R’. При этом радикалы R и R’ могут быть как одинаковые, так и разные. Например:
| СH3-NH-CH3 | СH3-NH-CH2-CH3 |
| диметиламин | метилэтиламин |
Если в аминах отсутствуют атомы водорода при атоме азота, т.е. все три атома водорода молекулы аммиака замещены на углеводородный радикал, то такие амины называют третичными аминами. В общем виде формулу третичного амина можно записать как:
При этом радикалы R, R’, R’’ могут быть как полностью одинаковыми, так и все три разные.
Общая молекулярная формула первичных, вторичных и третичных предельных аминов имеет вид CnH2n+3N.
Ароматические амины с только одним непредельным заместителем имеют общую формулу CnH2n-5N
Важность органической химии
Запах и вкус клубники
Ароматы розы
Ацетилсалициловая кислота (аспирин) — почти все препараты органического происхождения
Вещества органической химии присутствуют практически во всех товарах, которыми мы пользуемся каждый день. В красителях в иллюстрированных книгах, журналах, печатная упаковка, пластмассы в большинстве наших потребительских товаров в почти каждой игрушке, в компьютерных случаях , в трубопроводах, кабелях, сумки и т.д., органических синтетических волокна в больших частях нашей одежды , что краски для фасадов домов, автомобилей, гостиной, на чистящие средства от простых до сложных мыла поверхностно -активных веществ для специальных применений, в фармацевтике , ароматы и ароматы в продуктах питания и цветы, пищевые консерванты, в ионитов в опреснительных установках. Дерево и хлопок также являются органическими веществами; их можно получить от природы, потому что их много. Однако большинство органических веществ должно производиться на синтетической основе — в основном из нефти — в химической промышленности. В случае нехватки сырой нефти во всем мире другое ископаемое сырье, такое как уголь или природный газ, в настоящее время можно было бы использовать только в ограниченной степени для производства органических веществ, необходимых на повседневной основе. Высокая цена на сырую нефть требует усилий по развитию процессов замещения на основе угля и природного газа. Однако эти процессы будут менее рентабельны, чем нефтяные. При очень высоких ценах на сырую нефть может возникнуть нехватка товаров народного потребления.
Изомерия
К середине 19-го века, когда было получено и изучено достаточно много органических соединений, химики-органики обнаружили непонятное явление: соединения, имеющие одинаковый состав, имели разные свойства! Например, газ, который с трудом вступает в реакции и не реагирует с Nа, имеет состав C2H6O. Но существует жидкость, имеющая тот же состав и очень активная в химическом отношении. В частности, эта жидкость состава C2H6O активно реагировала с Na, выделяя водород. Совершенно разные по физическим и химическим свойствам вещества имеют одинаковую молекулярную формулу! Почему? Ответ на этот вопрос можно получить при помощи теории строения органических соединений Бутлерова, одно из положений которой утверждает: «Свойства органических соединений зависят от химического строения их молекул».
Так как химические свойства рассматриваемых соединений различны, значит, их молекулы имеют разное строение. Попробуем составить графические формулы этих соединений. Для вещества состава C2H6O можно предложить только два вида цепочек:
Заполнив эти «скелеты» атомами водорода, получаем:
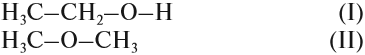
Вопрос. Какое из этих соединений способно реагировать с Nа, выделяя водород?
Очевидно, к такому взаимодействию способно только вещество (I), содержащее связь «О–Н», которой нет в молекуле (II). И газ Н2 выделяется потому, что разрушается связь «О–Н». Если бы для образования водорода нужно было бы разрушить связь «С–Н», то поскольку такие связи есть в обоих веществах, газ Н2 выделялся бы в обоих случаях. Таким образом, формула (I) отражает строение молекулы жидкости, а формула (II) — газа.
Существование соединений, которые имеют одинаковый состав, но разное химическое строение, называется изомерией.
ИЗОМЕРЫ — это соединения, которые имеют одинаковый состав, но разное химическое строение, а значит, и разные свойства.
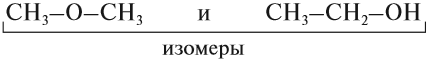
Поэтому молекулы органических соединений следует изображать при помощи графических (структурных) формул, так как в этом случае будет видно строение изучаемого вещества, а значит, будет видно, как и за счёт чего происходит химическая реакция.
Упражнение 17.1. Среди следующих соединений найдите изомеры:
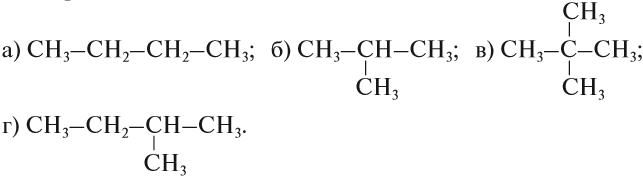
Решение. Поскольку изомеры имеют одинаковый состав, определим состав (молекулярные формулы) всех этих соединений, то есть пересчитаем число атомов углерода и водорода:
![]()
Ответ. Соединения а) и б) изомерны друг другу, так как имеют одинаковый состав C4H10, но различное химическое строение.
Соединения в) и г) изомерны друг другу, так как имеют одинаковый состав C5H12, но различное химическое строение.
Задание 17.2. Среди следующих соединений найдите изомеры:
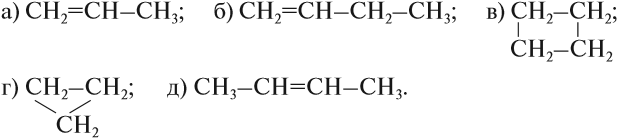

Отличие от неорганической химии
За некоторыми исключениями, органическая химия включает в себя химию всех соединений, которые углерод образует с самим собой и с другими элементами. Это также включает в себя все строительные блоки известной в настоящее время жизни. В 2012 году было известно около 40 миллионов органических соединений.
Исключения включают в себя формальные первые элементные формах углерода ( графит , алмаз ) и систематически все ссылки без любой атомной связи углерода-водорода, например, к неорганической химии считая водород , свободные халькогениды углерода ( окиси углерода , двуокись углерода , сероуглерод ) , угольная кислота и карбонаты , карбиды, а также ионные цианиды , цианаты и тиоцианаты (см. ).
Синильная кислота является частью пограничной области неорганической и органической химии. Хотя он традиционно считается частью неорганической химии, он считается нитрилом (органической группой веществ) муравьиной кислоты . Цианиды относятся к неорганическим, причем здесь подразумеваются только соли цианистого водорода, тогда как сложные эфиры, известные под тем же названием, относятся к органическим, как нитрилы. В голубых кислородных кислотах , тиоциановая кислота и их сложные эфиры, также рассматриваются случаи пограничных. Кроме того, металлоорганическую химию ( металлоорганическую химию ) нельзя специально отнести к органической или неорганической химии.
Совершенно неестественные на вид вещества, такие как пластмассы и нефть , также являются органическими соединениями, поскольку, как и природные вещества, они состоят из соединений углерода. Сырая нефть, природный газ и уголь, сырье для многих синтетических продуктов, в конечном итоге имеют органическое происхождение.
Все живые существа содержат органические вещества, такие как аминокислоты , белки , углеводы и ДНК . Раздел органической химии, изучающий вещества и метаболические процессы в живых существах, — это биохимия (или молекулярная биология ).
Мы узнаем — Жиры — доклад сообщение по химии. Подсказки школьнику
В химии есть 2 раздела: органика и неорганика. В органическую химию входит много соединений: спирты, нуклеиновые кислоты, алканы, алкены, белки и так далее. Одними из представителей данного раздела являются жиры, они же триглицериды.
Жиры – это органические соединения, главными компонентами которого являются карбоновые кислоты и глицерин. Большинство из жиров образовано тремя кислотами – олеиновой, пальмитиновой и стеариновой.
Также жиры состоят из разных жирных кислот. Например, линоленовая. Все такие кислоты делятся на насыщенные и ненасыщенные. Количество энергетической ценности составляет 9, 3 ккал/грамм. Проще говоря, растрачиваемая энергия с 1 грамма жира – то же самое, что поднимать груз весом в 4000 килограмм. Точный состав триглицеридов был опознан двумя французами, а именно, Шеврель заметил, что, если при соединении жира и воды в щелочной среде разогревать смесь, то будет образовываться глицерин и кислота. Потом Бертло, нагревая соединение глицерина и карбоновой кислоты, впервые получил жир.
Страницы
- Главная страница
- ОСНОВЫ ОБЩЕЙ ХИМИИ
- 1.1 Важнейшие классы неорганических веществ
- 2.1 Вещества. Атомы
- 2.2 Размеры атомов
- 2.3 Молекулы. Химические формулы
- 2.4 Простые и сложные вещества
- 2.5 Валентность элементов
- 2.6 Моль. Молярная масса
- 2.7 Закон Авогадро
- 2.8 Закон сохранения массы веществ
- 2.9 Вывод химических формул
- 3.1 Строение атома. Химическая связь
- 3.2 Строение атома
- 3.4 Строение электронной оболочки атома
- 3.5 Периодическая система химических элементов
- 3.6 Зависимость свойств элементов
- 3.7 Химическая связь и строение вещества
- 3.8 Гибридизация орбиталей
- 3.9 Донорно-акцепторный механизм образования
- 3.10 Степени окисления элементов
- 4.1 Классификация химических реакций
- 4.2 Тепловые эффекты реакций
- 4.3 Скорость химических реакций
- 4.4 Необратимые и обратимые реакции
- 4.5 Общая классификация химических реакций
- НЕОРГАНИЧЕСКАЯ ХИМИЯ
- 5.1 Растворы. Электролитическая диссоциация
- 5.2 Количественная характеристика состава растворов
- 5.3 Электролитическая диссоциация
- 5.4 Диссоциация кислот, оснований и солей
- 5.5 Диссоциация воды
- 5.6 Реакции обмена в водных растворах электролитов
- 5.7 Гидролиз солей
- 6.1 Важнейшие классы неорганических веществ
- 6.2 Кислоты, их свойства и получение
- 6.3 Амфотерные гидроксиды
- 6.4 Соли, их свойства и получение
- 6.5 Генетическая связь между важнейшими классами
- 6.6 Понятие о двойных солях
- 7.1 Металлы и их соединения
- 7.2 Электролиз
- 7.3 Общая характеристика металлов
- 7.4 Металлы главных подгрупп I и II групп
- 7.5 Алюминий
- 7.6 Железо
- 7.7 Хром
- 7.8 Важнейшие соединения марганца и меди
- 8.1 Неметаллы и их неорганические соединения
- 8.2 Водород, его получение
- 8.3 Галогены. Хлор
- 8.4 Халькогены. Кислород
- 8.5 Сера и ее важнейшие соединения
- 8.6 Азот. Аммиак. Соли аммония
- 8.7 Оксиды азота. Азотная кислота
- 8.8 Фосфор и его соединения
- 8.9 Углерод и его важнейшие соединения
- 8.10 Кремний и его важнейшие соединения
- ОРГАНИЧЕСКАЯ ХИМИЯ
- 9.1 Основные положения органической химии. Углеводороды
- 9.2 Электронные эффекты заместителей в органических соединениях
- 9.3 Предельные углеводороды (алканы)
- 9.3.1 Насыщенные УВ. Метан
- 9.4 Понятие о циклоалканах
- 9.5 Непредельные углеводороды
- 9.6 Диеновые углеводороды (алкадиены)
- 9.7 Алкины
- 9.8 Ароматические углеводороды
- 9.9 Природные источники углеводородов
- 10.1 Кислородсодержащие органические соединения
- 10.2 Фенолы
- 10.3 Альдегиды
- 10.4 Карбоновые кислоты
- 10.5 Сложные эфиры. Жиры
- 10.6 Понятие о поверхностно-активных веществах
- 10.7 Углеводы
- 11.1 Амины. Аминокислоты
- 11.2 Белки
- 11.3 Понятие о гетероциклических соединениях
- 11.4 Нуклеиновые кислоты
- 12.1 Высокомолекулярные соединения
- 12.2 Синтетические волокна
Основные различия
Основное различие между органической и неорганической химией заключается в составе химических соединений и способах их образования. В органической химии соединения содержат углерод, а также другие элементы, такие как водород, кислород, азот, фосфор и многие другие. В неорганической химии соединения могут содержать различные элементы, за исключением углерода, хотя некоторые неорганические соединения также могут содержать углеродатомы, но их обычно рассматривают как исключения.
Органическая химия также изучает органические реакции, которые происходят между органическими соединениями, такими как окисление, восстановление, замещение функциональных групп и многие другие. В то же время, неорганическая химия изучает реакции и свойства неорганических соединений, таких как соли, кислоты, основания, оксиды и т. д
Важно отметить, что органическая химия обычно более связана с изучением соединений, которые связаны с жизненными процессами и организмами, в то время как неорганическая химия фокусируется на неорганических веществах, которые обычно не связаны с жизнью
Альдегиды и кетоны
Альдегидами называют производные углеводородов, у которых при первичном атоме углерода два атома водорода заменены на один атом кислорода, т.е. производные углеводородов в структуре которых имеется альдегидная группа –СН=О. Общую формулу альдегидов можно записать как R-CH=O. Например:
| этаналь | метаналь |
Кетонами называют производные углеводородов, у которых при вторичном атоме углерода два атома водорода заменены на атом кислорода, т.е. соединения, в структуре которых есть карбонильная группа –C(O)-.
Общая формула кетонов может быть записана как R-C(O)-R’. При этом радикалы R, R’ могут быть как одинаковыми, так и разными.
Например:
| пропанон | бутанон |
Как можно заметить, альдегиды и кетоны весьма схожи по строению, однако их все-таки их различают как классы, поскольку они имеют существенные различия в химических свойствах.
Общая молекулярная формула предельных кетонов и альдегидов одинакова и имеет вид CnH2nO
Примеры решения задач
| Задание | Растительное масло массой 17,56 г нагрели с 3,36 г гидроксида калия до полного исчезновения масляного слоя. При действии избытка бромной воды на полученный после гидролиза раствор образуется только одно тетрабромпроизводное. Установите возможную формулу жира. |
| Решение | Запишем в общем виде уравнение гидролиза жира: |
На 1 моль жира при гидролизе приходится 3 моль гидроксида калия. Найдем количество вещества гидроксида калия и жира, причем, количество жира втрое меньше:
Зная количество и массу жира, можно найти его молярную массу:
На три углеводородных радикала R кислот приходится 705 г/моль:
Зная, что тетрабромпроизводное получено только одно, можно сделать вывод, что все кислотные остатки одинаковы и содержат по 2 двойные связи. Тогда получаем, что в каждом радикале содержится 17 атомов углерода, это радикал линолевой кислоты:
Возможная формула жира:
Ответ
Искомый жир — тилинолен
| Задание | Напишите две возможные формулы жира, имеющего в молекуле 57 атомов углерода и вступающего в реакцию с иодом в соотношении 1:2. В составе жира имеются остатки кислот с четным числом углеродных атомов. |
| Ответ | Общая формула жиров: |
где R, R’, R» — углеводородные радикалы, содержащие нечетное число атомов углерода (еще один атом из кислотного остатка входит в состав группы -СО-). На долю трех углеводородных радикалов приходится 57- 6 = 51 атом углерода. Можно предположить, что каждый из радикалов содержит по 17 атомов углерода.
Поскольку одна молекула жира может присоединить две молекулы иода, то на три радикала приходится две двойные связи или одна тройная. Если две двойные связи находятся в одном радикале, то в состав жира входят остаток линолевой кислоты (R = С17Н31) и два остатка стеариновой кислоты (R’ = R» = С17Н35). Если две двойные связи находятся в разных радикалах, то в состав жира входят два остатка олеиновой кислоты (R = R’ = С 17H33) и остаток стеариновой кислоты (R» = С17Н35). Возможные формулы жира:
Жиры – доклад сообщение по химии
На нашем сайте собрано более 100 бесплатных онлайн калькуляторов по математике, геометрии и физике.
Основные формулы, таблицы и теоремы для учащихся. Все что нужно, чтобы сделать домашнее задание!
Не можете решить контрольную?! Мы поможем! Более 20 000 авторов выполнят вашу работу от 100 руб!
Жиры и масла (жидкие жиры) – важные природные соединения. Все жиры и масла растительного происхождения почти целиком состоят из сложных эфиров глицерина (триглицеридов). В этих соединениях глицерин этерифицирован высшими карбоновыми кислотами.
Жиры имеют общую формулу:
Здесь R, R’, R’’ – углеводородные радикалы.
Три гидроксогруппы глицерина могут быть этерифицированы либо только одной кислотой, например пальмитиновой или олеиновой, либо двумя или тремя различными кислотами:
Основные предельные кислоты, образующие жиры – пальмитиновая С15Н31СООН и стеариновая С17Н35СООН; основные непредельные кислоты – олеиновая С17Н33СООН и линолевая С17Н31СООН.
Индивидуальные доказательства
- Furni Novi Philosophici I, 1648-1650 Амстердам, 66-я
- Furni Novi Philosophici I, 1648-1650 Амстердам, 77-я
- Furni Novi Philosophici I, Амстердам 1648–1650, 99.
- Furni Novi Philosophici II, Амстердам 1648–1650, 181.
- Furni Novi Philosophici II, Амстердам 1648–1650, 71.
- Opera Chymica I, 50-е.
- Погг. Анна. 31: 1-43 (1831).
- Отто Вестфаль , Теодор Виланд , Генрих Хюбшманн: регулятор жизни. Гормонов, витаминов, ферментов и других активных ингредиентов. Societäts-Verlag, Франкфурт-на-Майне, 1941 г. (= Frankfurter Bücher. Исследования и жизнь. Том 1), стр. 38.
- Гилбертс Энн. 40 , 247.
- Ann. Хим. Физ. 24 , 264.
- Погг. Анна. 12 , 253 (1828).
- Герман Кольбе, О естественной связи между органическими и неорганическими соединениями, научной основе естественной классификации органических химических тел Ann. Chem. , 113 , 1860, 293.
- Фридрих Август Кекуле: О парных соединениях и теории многоатомных радикалов . В: Liebigs Annalen Chemie дер 104/2, 1857 г., стр 129-256,. DOI :
- Мориц Малищевски, К. Сеппельт: Молекулярная структура пятиугольно-пирамидального дикатона гексаметилбензола в кристалле. В: Angewandte Chemie, 129, 2017 г., стр. 374, DOI : .
- Ханс-Бернд Амеке: Краткий обзор химической промышленности , стр. 74-75, VCH Verlagsgesellschaft mbH, Weinheim 1987, ISBN 3-527-26540-6 .
- Ханс-Бернд Амеке: Обзор химической промышленности, стр. 74-85, VCH Verlagsgesellschaft mbH, Weinheim 1987 ISBN 3-527-26540-6 .
- Ханс-Бернд Амеке: Обзор химической промышленности, стр. 109–129, VCH Verlagsgesellschaft mbH, Weinheim 1987 ISBN 3-527-26540-6 .
Реакции
См. Механизм реакции
Реакции в органической химии в основном можно разделить на следующие основные типы:
- Радикальная замена (S R )
-
Нуклеофильное замещение (S N ):
- Нуклеофильное алифатическое замещение
- Нуклеофильное ароматическое замещение
-
Электрофильное замещение (S E ):
- Электрофильное алифатическое замещение
- Электрофильное ароматическое замещение
- Устранение
- Нуклеофильное добавление (A N )
- Электрофильное добавление (A E )
- Радикальное дополнение (A R )
- Перициклические реакции
- Перегруппировка (если они не относятся к типам реакций, указанным выше)
- Окисление и восстановление
Кроме того, многие реакции известны по имени их первооткрывателя (см. Список именных реакций ).
Классификацию по типу связи или строительного блока можно найти в списке реакций в органической химии .
Формулы органических соединений
Формулы органических соединений можно изображать по-разному. Состав молекулы отражает молекулярная (эмпирическая) формула:
Но эта формула не показывает расположения атомов в молекуле, т. е. строения молекулы вещества. А в органической химии это понятие — химическое строение молекулы вещества — самое главное! Последовательность соединения атомов в молекуле показывает графическая (структурная) формула. Например, для вещества строения С4Н10 можно написать две такие формулы:
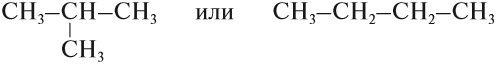
Можно показать все химические связи:
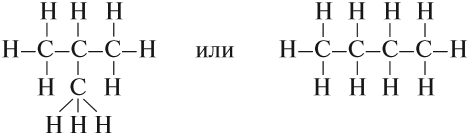
Такие развёрнутые графические формулы наглядно показывают, что атом углерода в органических молекулах четырёхвалентен. При составлении графических формул нужно сначала изобразить углеродную цепь, например:
Затем чёрточками обозначить валентность каждого атома углерода:
У каждого атома углерода должно быть четыре чёрточки!
Затем заполнить «свободные» валентности атомами водорода (или другими одновалентными атомами или группами).
Теперь можно переписать эту формулу в сокращённом виде:
Если вы хотите сразу написать такую формулу для бутана — ничего сложного нет, нужно только считать до четырёх. Изобразив углеродный «скелет», нужно задать себе вопрос: сколько валентностей (чёрточек) имеет данный конкретный атом углерода?
Две. Значит, нужно добавить 2 атома водорода:
Следует помнить, что графические формулы можно записывать по-разному. Например, графическую формулу бутана можно записать так:
или так:
и так далее.
Поскольку последовательность расположения атомов не нарушилась, то это формулы одного и того же соединения(!) Проверить себя можно, составив названия этих соединений (см урок 17.7). Если названия веществ совпадают, то это — формулы одного и того же вещества.
Амины
Аминами называют производные аммиака, в которых один, два или все три атома водорода замещены на углеводородный радикал.
Амины, в которых только один атом водорода замещен на углеводородный радикал, т.е. имеющие общую формулу R-NH2, называют первичными аминами.
Амины, в которых два атома водорода замещены на углеводородные радикалы, называют вторичными аминами. Формулу вторичного амина можно записать как R-NH-R’. При этом радикалы R и R’ могут быть как одинаковые, так и разные. Например:
| СH3-NH-CH3 | СH3-NH-CH2-CH3 |
| диметиламин | метилэтиламин |
Если в аминах отсутствуют атомы водорода при атоме азота, т.е. все три атома водорода молекулы аммиака замещены на углеводородный радикал, то такие амины называют третичными аминами. В общем виде формулу третичного амина можно записать как:
При этом радикалы R, R’, R’’ могут быть как полностью одинаковыми, так и все три разные.
Общая молекулярная формула первичных, вторичных и третичных предельных аминов имеет вид CnH2n+3N.
Ароматические амины с только одним непредельным заместителем имеют общую формулу CnH2n-5N
Предмет органической химии. Теория строения органических веществ
Органические вещества известны людям с давних пор. Ещё в древности люди использовали сахар, животные и растительные жиры, красящие и душистые вещества. Все эти вещества выделялись из живых организмов. Поэтому такие соединения стали называться органическими, а раздел химии, который изучал вещества, образующиеся в результате жизнедеятельности живых организмов, получил название «органическая химия». Это определение было дано шведским учёным Берцелиусом* в 1827 году.
Уже первые исследователи органических веществ отмечали особенности этих соединений. Во-первых, все они при сжигании образуют углекислый газ и воду, значит, все они содержат атомы углерода и водорода. Во-вторых, эти соединения имели более сложное строение, чем минеральные (неорганические) вещества. В-третьих, возникали серьёзные затруднения, связанные со способами получения и очистки этих соединений. Полагали даже, что органические соединения невозможно получить без участия «жизненной силы», которая присуща только живым организмам, то есть органические соединения нельзя, казалось, получить искусственно.
И, наконец, были обнаружены соединения одинакового молекулярного состава, но различные по свойствам. Такое явление не было характерно для неорганических веществ. Если для неорганического вещества известен состав, то известны и его свойства.
Вопрос. Какими свойствами обладают H2SO4; Ca(OH)2?
А химики-органики обнаружили, что вещество состава С2Н6О у одних исследователей является достаточно инертным газом, а у других — жидкостью, активно вступающей в разнообразные реакции. Как это объяснить?
К середине 19-го века было создано немало теорий, авторы которых пытались объяснить эти и другие особенности органических соединений. Одной из таких теорий стала теория химического строения Бутлерова*.
Некоторые её положения были изложены А. М. Бутлеровым в 1861 году на конференции в г. Шпейере, другие были сформулированы позже в научных работах А. М. Бутлерова. В целом, основные положения этой теории в современном изложении можно сформулировать так.
1. Атомы в молекулах располагаются в строгом порядке, согласно их валентности.
2. Атом углерода в органических молекулах всегда имеет валентность равную четырём.
3. Порядок соединений атомов в молекуле и характер химических связей между атомами называется химическим строением.
4. Свойства органических соединений зависят не только от того, какие атомы и в каких количествах входят в состав молекулы, но и от химического строения:
- вещества разного строения имеют разные свойства;
- вещества похожего строения имеют похожие свойства.
5. Изучая свойства органических соединений, можно сделать вывод о строении данного вещества и описать это строение одной-единственной химической формулой.
6. Атомы в молекуле влияют друг на друга, и это влияние сказывается на свойствах вещества.
При изучении органической химии нужно чаще вспоминать эти положения и, прежде чем описывать свойства какого-либо вещества, следует указать его строение при помощи химической формулы, в которой будет показан порядок соединения атомов в молекуле — графическая формула.

литература
- Карл Шорлеммер : происхождение и развитие органической химии , Академическая издательская компания Geest & Portig, Лейпциг, 1984.
- Х. Харт, Л. Е. Крейн, Д. Д. Харт, С. М. Хадад, Н. Киндлер: Органическая химия . 3-е издание Wiley-VCH, Weinheim 2007, ISBN 978-3-527-31801-8 .
- KPC Вольхардт и NE Schore: Органическая химия . 4-е издание, Wiley-VCH, Weinheim 2005, ISBN 978-3-527-31380-8 .
- Хайнц А. Стааб : Сто лет органической структурной химии. Angewandte Chemie 70 (2), стр 37-41 (1958),. DOI : .
- Иоахим Буддрус: основы органической химии , Вальтер де Грюйтер, Берлин — Нью-Йорк, 3-е издание 2003 г., ISBN 978-3-11-014683-7 .
- Хартмут Лаач: Методика анализа разделения органических веществ , Георг Тим Верлаг Штутгарт / Нью-Йорк 1988, ISBN 3-13-722801-8 .
- dtv-atlas chemistry (Hans Breuer): Volume 2: Organic Chemistry and Plastics , 9th edition 2006, Deutscher Taschenbuch Verlag, ISBN 3-423-03218-9 .
- Р. Л. Шрайнер, Р. К. Фусон, Д. Ю. Кертин, Т. К. Моррилл: Систематическая идентификация органических соединений — лабораторное руководство, 6-е издание, John Wiley & Sons New York / Chichester / Brisbane / Toronto 1980, ISBN 0-471-78874-0 .
Группы веществ в органической химии
Есть две возможности систематической классификации отдельных веществ в органической химии на группы веществ:
Классификация по функциональной группе
- Углеводороды без функциональной группы являются исходным сырьем для органической химии и основой их номенклатуры .
- Галоидоуглероды — это углеводороды, в которых по крайней мере один атом водорода заменен одним из галогенов — фтором, хлором, бромом или йодом.
- Кислородные и гидроксисоединения
- Спирты
- Альдегиды
- Сложный эфир
- Эфир
- Кетоны
- Карбоновые кислоты
- Соединения азота
- Амины
- Амиды
- Соли диазония
- Нитросоединения , например TNT
- Нитрилы
- Соединения серы
- Алканетиолы
- Сульфиды
- Дисульфиды
- Эфир серной кислоты
- Сульфоны
- Сульфоксиды
- Тионамиды
- Тиолестер
- Тиоевая кислота
- Соединения фосфора
- Сложный эфир фосфорной кислоты
- Фосфины , например трифенилфосфин
- Металлоорганические соединения , например ферроцен
Классификация по структуре углерода
Циклогексан , насыщенный циклический алифатический
-
алифатические углеводороды (алифатические)
- ациклические углеводороды
- насыщенные ( алканы )
- ненасыщенные ( алкены и алкины )
- циклические углеводороды
- ациклические углеводороды
-
ароматические углеводороды (ароматические углеводороды )
- простая ароматика
- конденсированные ароматические углеводороды
- Гетероциклы
- биохимические соединения ( алкалоиды , аминокислоты , углеводы , белки , стероиды , терпены , витамины )
Основные представители каждой группы
В органической химии наиболее известным и популярным элементом является углерод. Углеродная химия изучает огромное количество органических соединений, таких как углеводы, жиры, белки, нуклеиновые кислоты и многое другое. Кроме углерода, другие важные элементы в органической химии включают водород, кислород, азот, фосфор и серу.
Неорганическая химия, с другой стороны, имеет широкий спектр популярных элементов. Некоторые из них включают натрий, калий, железо, медь, цинк, серебро, золото, кислород, азот, хлор и фтор
В неорганической химии важно изучать и понимать свойства и реакции этих элементов и соединений, которые они формируют





























