Слайды и текст этой презентации
Слайд 1
Обратимые реакции.
Химическое равновесие.
Тест – обобщение по темамТест составлен по
МО г. Нягань «СОШ №6»Ким Н.В.

Слайд 2А1. Обратимая химическая реакция – это: 1) гидролиз хлорида железа(III);
2) горение природного газа; 3) варка яйца; 4) затвердевание цемента.
А2. Подвергается обратимому гидролизу следующая соль: 1) сульфид железа; 2) карбид кальция; 3) сульфит натрия; 4) хлорид натрия.

Слайд 3А3. Начальная скорость растворения цинка в соляной кислоте не зависит
от: 1) степени измельчения цинка; 2) температуры раствора HCl; 3)
концентрации HCl; 4) размера пробирки. А4. Состояние химического равновесияхарактеризуется: 1) прекращением протекания прямой и обратной химической реакций; 2) равенством скоростей прямой и обратной реакций; 3) равенством суммарной массы продуктов суммарной массе реагентов; 4) равенством суммарного количества вещества продуктов суммарному количеству вещества реагентов.

Слайд 4А5. Обратимая реакция 2NO (г.) + O2 (г.) 2NO2 (г.)
+ Q находится в состоянии равновесия. При каких условиях скорость
обратной реакции увеличится в большей степени, чем скорость прямой реакции? 1) Понижение давления; 2) повышение температуры; 3) повышение давления; 4) применение катализатора. А6. Для увеличения выхода сложного эфира в химическом процессе CH3OH + HCOOH HCOOCH3 + H2O – Q необходимо:1) добавить воды; 2) уменьшить концентрацию муравьиной кислоты; 3) увеличить концентрацию эфира; 4) увеличить температуру.

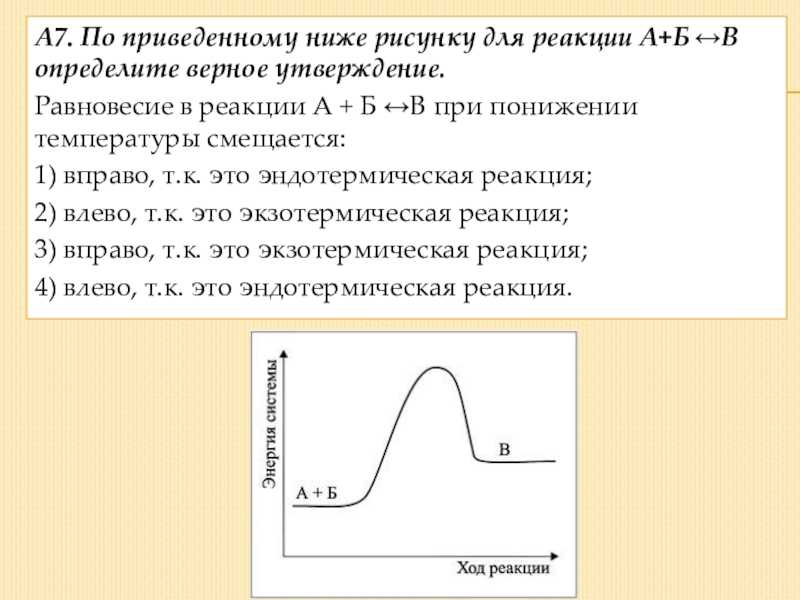
Слайд 5А7. По приведенному ниже рисунку для реакции А+Б В определите
верное утверждение. Равновесие в реакции А + Б В при
понижении температуры смещается: 1) вправо, т.к. это эндотермическая реакция; 2) влево, т.к. это экзотермическая реакция; 3) вправо, т.к. это экзотермическая реакция; 4) влево, т.к. это эндотермическая реакция.
Слайд 6А8. При изменении давления химическое равновесие не смещается в следующей
реакции: 1) СО (г.) + Сl2 (г.) СОСl2 (г.);
2) СО2 (г.) + С 2СО (г.); 3) 2СО (г.) + О2 (г.) 2СО2 (г.);4) С + О2 (г.) СО2 (г.).А9. При повышении давления химическое равновесие смещается в сторону: 1) эндотермической реакции; 2) экзотермической реакции; 3) уменьшения объема реакционной смеси; 4) увеличения объема реакционной смеси.

1) увеличит скорость только прямой реакции; 2) увеличит скорость только
обратной реакции; 3) увеличит скорость как прямой, так и обратной реакции; 4) не оказывает влияние на скорость ни прямой, ни обратной реакции.


они возможны.


Слайд 12В6. Реакции, протекающие без катализатора, – это: 1) 2С +
О2 = 2СО; 2) СО + 2Н2 = СН3ОН; 3)
2KNO3 = 2KNO2 + O2; 4) C6H6 + Cl2 = C6H5Cl + HCl; 5) Р4 + 5О2 = 2Р2О5; 6) 4NH3 + 5O2 = 4NO + 6H2O. В7. Необратимые реакции – это:1) PCl3 + Cl2 = PCl5; 2) Fe + CuSO4 = FeSO4 + Cu; 3) CO + H2 = CH2O; 4) C + O2 = CO2; 5) 2H2O2 = 2H2О + O2; 6) Na2CO3 + H2O = NaHCO3 + NaOH.

Слайд 13В8. Хлор необратимо реагирует со следующими веществами: 1) водой;
2) гидроксидом кальция; 3) водородом; 4) йодидом калия; 5) угарным газом; 6) метаном при облучении светом. В9. Вещества, растворение которых в воде сопровождается поглощением энергии, – это: 1) оксид кальция; 2) серная кислота; 3) хлорид натрия; 4) нитрат калия; 5) гидроксид натрия; 6) нитрат аммония. В10. Вещество, обжиг которого является эндотермической реакцией, – это:1) пирит; 2) известняк; 3) доломит; 4) цинковая обманка; 5) колчедан; 6) медный купорос.

Результаты тестирования
Незарегистрированный посетитель
2023-05-30 21:43:13
36%
2
Незарегистрированный посетитель
2023-05-30 21:37:03
21%
1
Незарегистрированный посетитель
2023-05-30 20:34:50
36%
2
Незарегистрированный посетитель
2023-05-30 20:34:07
29%
1
Незарегистрированный посетитель
2023-05-30 20:31:48
14%
1
Незарегистрированный посетитель
2023-01-24 20:46:58
79%
4
Незарегистрированный посетитель
2023-01-24 20:46:42
64%
3
Незарегистрированный посетитель
2023-01-24 20:46:26
64%
3
Незарегистрированный посетитель
2023-01-24 20:45:49
36%
2
Незарегистрированный посетитель
2022-11-08 17:01:52
29%
1
Незарегистрированный посетитель
2022-10-26 19:05:48
0%
Незарегистрированный посетитель
2022-10-24 20:50:39
36%
2
Незарегистрированный посетитель
2022-10-23 21:50:42
7%
Незарегистрированный посетитель
2022-10-20 18:53:51
43%
2
Незарегистрированный посетитель
2022-10-19 22:10:46
43%
2
Незарегистрированный посетитель
2022-10-19 21:28:05
0%
Незарегистрированный посетитель
2022-10-19 18:33:40
100%
5
Незарегистрированный посетитель
2022-10-19 18:32:36
86%
4
Незарегистрированный посетитель
2022-10-19 18:32:17
93%
5
Незарегистрированный посетитель
2022-10-19 18:24:54
79%
4
Незарегистрированный посетитель
2022-10-19 17:30:32
100%
5
Незарегистрированный посетитель
2022-10-19 17:30:02
93%
5
Незарегистрированный посетитель
2022-10-19 17:28:37
64%
3
Незарегистрированный посетитель
2022-10-19 17:28:25
50%
3
Незарегистрированный посетитель
2022-10-19 17:28:03
43%
2
Незарегистрированный посетитель
2022-10-12 18:26:08
7%
Незарегистрированный посетитель
2022-10-12 00:32:40
29%
1
Незарегистрированный посетитель
2022-10-10 22:12:36
36%
2
Незарегистрированный посетитель
2022-10-09 18:08:02
29%
1
Незарегистрированный посетитель
2022-10-08 19:32:09
7%
Незарегистрированный посетитель
2022-10-08 19:31:37
14%
1
Незарегистрированный посетитель
2022-10-08 15:37:05
29%
1
Незарегистрированный посетитель
2022-10-07 18:36:44
86%
4
Незарегистрированный посетитель
2022-10-07 08:20:22
0%
Незарегистрированный посетитель
2022-10-05 17:08:35
57%
3
Незарегистрированный посетитель
2022-10-03 22:19:46
50%
3
Незарегистрированный посетитель
2022-10-03 19:38:06
100%
5
Незарегистрированный посетитель
2022-10-03 19:37:06
93%
5
Незарегистрированный посетитель
2022-10-03 19:34:52
79%
4
Незарегистрированный посетитель
2022-10-03 16:56:55
50%
3
Незарегистрированный посетитель
2022-10-02 21:09:24
29%
1
Незарегистрированный посетитель
2022-09-27 02:37:44
14%
1
Незарегистрированный посетитель
2022-09-26 19:29:35
50%
3
Незарегистрированный посетитель
2022-09-24 14:11:46
29%
1
Незарегистрированный посетитель
2022-09-24 14:11:27
29%
1
Незарегистрированный посетитель
2022-09-24 14:10:43
7%
Незарегистрированный посетитель
2022-09-24 14:10:06
21%
1
Незарегистрированный посетитель
2022-09-24 14:09:31
43%
2
Незарегистрированный посетитель
2022-09-24 14:09:03
21%
1
Незарегистрированный посетитель
2022-09-24 14:08:24
43%
2
Всего комментариев: 0
Часть 2
1. Среди нижеперечисленных характеристик укажите признаки химических реакций:
1) нагревание
2) выпадение осадка
3) введение катализатора
4) появление запаха
5) изменение окраски
6) повышение давления
Ответ дайте в виде последовательности цифр в порядке их возрастания.
2. Установите соответствие между схемой химической реакции и веществом, являющимся окислителем в этой реакции. Ответ дайте в виде последовательности цифр, соответствующих буквам по алфавиту.
Схема реакции
А) H2SO3 + Н2О2 → H2SO4 + Н2О
Б) H2SO3 + H2S → S + Н2О
В) HCl + MnO2 → MnCl2 + Cl2 + Н2О
Г) HCl + Mg → MgCl2 + Н2О
Окислитель
1) Mg
2) 2H2O
3) MnO2
4) HCl
5) H2S
6) H2SO3
3. Используя Интернет, познакомьтесь с понятием молекулярности химической реакции. Установите соответствие между уравнением реакции и молекулярностью этой реакции. Ответ дайте в виде последовательности цифр, соответствующих буквам по алфавиту.
Уравнение реакции
А) H2S = Н2 + S
Б) 2NO + Н2 = N2O + Н2О
В) N2O4 = 2NO2
Г) NO + Н2О = NO2 + Н2
Реакция
1) мономолекулярная
2) бимолекулярная
3) тримолекулярная
Ответы на тест по химии Химические реакции. Скорость химической реакции 9 классЧасть 1
1-2
2-3
3-1
4-4
5-3
6-2
7-1
8-4
9-4
10-2
11-2
12-4
13-1
14-2
15-4Часть 2
1-245
2-2634
3-1312
Часть 1
1. Эндотермическая реакция соединения
1) 2Mg + O2 = 2MgO + Q
2) N2 + O2 = 2NO − Q
3) CaCO3 = CaO + CO2 − Q
4) NaOH + HCl = NaCl + H2O + Q
2. Гетерогенная реакция обмена
1) Fe + CuSO4 = Cu + FeSO4
2) 2) СаО + СO2 = СаСО3
3) CuS + H2SO4 = CuSO4 + H2S
4) NaOH + HCl = NaCl + Н2О
3. Азот имеет степень окисления +3 в соединении
1) KNO2
2) Li3N
3) (NH4)2SO4
4) NH3
4. Окислительно-восстановительная реакция
1) ZnO + 2НСl = 2ZnCl2 + Н2O
2) СаСO3 + 2НСl = CaCl2 + Н2О + СО2
3) Cu(OH)2 = CuO + Н2O
4) 2AgNO3 = 2Ag + 2NO2 + O2
5. Признаком протекания химической реакции между раствором ацетата натрия и серной кислотой является
1) выпадение осадка
2) выделение газа
3) появление запаха
4) изменение цвета
6. Скорость взаимодействия раствора соляной кислоты максимальна с кусочком
1) железа
2) магния
3) цинка
4) меди
7. Верны ли следующие суждения?
А. Скорость химической реакции — это изменение концентрации реагентов за единицу времени.
Б. Концентрация компонента в смеси -это отношение массы компонента к объему смеси.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
8. Скорость реакции возрастает при увеличении
1) объема продуктов реакции
2) концентрации продуктов реакции
3) объема реагентов
4) концентрации реагентов
9. Укажите реакцию, которая при обычных условиях протекает с наибольшей скоростью.
1) Zn + 2НСl = MgCl2 + Н2
2) 6Li + N2 = 2Li3N
3) S + O2 = SO2
4) Ag+ + Cl− = AgCl↓.
10. Соляная кислота с максимальной скоростью реагирует с железом, которое находится в виде
1) стружки
2) слитка
3) порошка
4) пластинки
11. Верны ли следующие суждения?
А. При повышении температуры скорость любой химической реакции увеличивается.
Б. При понижении температуры на 10 °С скорость химической реакции уменьшается в 2-4 раза.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
12. Во сколько раз увеличится скорость химической реакции при нагревании на 30 °С, если температурный коэффициент реакции равен двум?
1) в 2 раза
2) в 4 раза
3) в 6 раз
4) в 8 раз
13. Во сколько раз увеличится скорость реакции
Н2 (г) + I2 (г) → 2HI(г)
при увеличении давления в два раза?
1) в 4 раза
2) в 3 раза
3) в 2 раза
4) не изменится
14. С наибольшей скоростью при комнатной температуре протекает реакция
1) железа с серой
2) растворов гидроксида калия и серной кислоты
3) меди с раствором азотной кислоты
4) оксида магния с раствором соляной кислоты
15. Скорость реакции Fe(тв.) + H2SO4 (р-р) = FeSO4 (р-р) + Н2 (г) + Q повысится при
1) понижении давления
2) разбавлении раствора кислоты
3) понижении температуры
4) измельчении железа






























