Ортофосфорная кислота, фосфорная кислота (Н3РO4)
Способы получения фосфорной кислоты
В промышленности Н3РO4 получают двумя способами:
Разложением природного соединения – фосфата кальция Са3(РO4)2 серной кислотой:
Доменный (термический) 3х-стадийный способ:
1 стадия — восстановление природных фосфоритов коксом
2 стадия – окисление получающихся паров свободного фосфора кислородом воздуха
3 стадия – орошение водой получающейся окиси фосфора:
Лабораторный способ
Н3РO4 получают окислением фосфора азотной кислотой:
Взаимодействием фосфорного ангидрида с водой:
Физические свойства, строение фосфорной кислоты
При обычной температуре безводная Н3РO4 – прозрачное, легкоплавкое (Тпл = 42°С) кристаллическое вещество. Н3РO4 -очень гигроскопичное вещество и смешивается с водой в любых соотношениях. Н3РO4 с небольшим количеством воды образует сиропообразную, вязкую жидкость.
Степень окисления фосфора в фосфорной кислоте равна +5, валентность равна V.
При нагревании орто-фосфорной кислоты выше +213 °C, она переходит в пирофосфорную H4P2O7.
При нагревании выше 700°С переходит в метафосфорную кислоту HPO3:
Качественные реакции для обнаружения фосфат-иона
Для обнаружения анионов фосфорной кислоты используют раствор AgNO3, при помощи которого также можно различить мета-, пиро- и ортофосфорные кислоты друг от друга.
При добавлении AgNO3 к кислотам образуются осадки различного цвета:
- метафосфат серебра AgPO3— белый
- пирофосфат серебра Ag4P2O7 – также белый, но он не свертывает яичного белка
- ортофосфат серебра Ag3PO4— желтый:
Химические свойства фосфорной кислоты
Фосфорная кислота H3PO4 – это электролит средней силы и представляет собой трехосновную кислоту.
Диссоциация протекает в основном по 1-й ступени:
По 2-й и 3-й ступеням диссоциация протекает в ничтожно малой степени:
Н3РO4 проявляет все общие свойства кислот — взаимодействует с активными металлами:
с основными оксидами:
с основаниями образует три ряда солей – одно-, двух- и трехзамещенные (кислые и средние соли):
с аммиаком образует соли аммония:
Вытесняет более слабые кислоты из их солей (карбонатов, сульфидов и др.). Также вступает в обменные реакции с солями:
При нагревании H3PO4 выше 200°С происходит отщепление молекулы воды с образованием пирофосфорной кислотыH2P2O7:
В отличие от аниона NO3 — в азотной кислоте, анион РO4 3- окисляющим действием не обладает.
Закон как выражение общей воли

Портрет Жан-Жака Руссо. (shopify.com)
Влияние взглядов Жан-Жака Руссо на общественную мысль колоссально. Его идеи и воззрения легли в основу Декларации прав человека. Первая статья начинается со знаменитого утверждения «Люди рождаются свободными. Они остаются свободными и равными в своих правах», которая практически дословно повторяет утверждение Руссо о том, что целью всякого политического объединения является сохранение естественных и неизменных прав человека. Эти права составляют право на свободу, собственность, безопасность и сопротивление давлению извне.
Вслед за английскими философами Джоном Локком и Томасом Гоббсом Руссо уделял пристальное внимание разработке гипотезы формирования государства по принципам общественного договора. Его идеи были основаны на народном суверенитете
Поскольку, рассуждал Руссо, государство возникает в результате общественного договора, то верховная власть в нем должна принадлежать всему народу. Суверенитет народа неотчуждаем, неделим, непогрешим и абсолютен. Закон как выражение общей воли выступает гарантией индивидов от произвола со стороны правительства, которое не может действовать, нарушая требования закона. Граждане должны иметь возможность вместе принимать основные нормы, по которым они будут жить, и право пересмотреть эти нормы позже, если те покажутся несправедливыми.
В знаменитом художественно-педагогическом трактате «Эмиль, или О воспитании» (1762) Руссо последовательно разрабатывает утверждение о «природе» женщины и мужчины, из которых мыслитель делает вывод об изначальной подчиненности женщины мужчине и о наличии существенных гендерных различий, которые потенциально могут превратить самостоятельное «дерево» в слабого «плюща» как метафору зависимого, несамостоятельного и в некоторой степени паразитирующего существа.
По мнению французского мыслителя, в отличие от мужчины, который «играет роль самца лишь в определенные моменты», женщина «является самкой в течение всей своей жизни», «все ее существование, ее конституция, не исключая и ее духа, темперамента и характера, определяются ее половыми функциями». В итоге, сводя женскую сущность к сексуальности, Руссо противопоставляет женщину и мужчину как два принципиально различных человеческих вида, не имеющих ничего общего, начиная с различий в еде и заканчивая оппозиций в сфере морали. Таким образом, оказывается логичным утверждение мыслителя о том, что цель воспитания девочки — подготовка к самоотречению и служению мужчине (мужу) в рамках супружеских отношений и материнских обязанностей, воспитание стремления нравиться мужчине, подчиняться его воле и зависеть от его расположения.
Лучшая характеристика Руссо дана биографом философа Артуром Шюке: «Робкий и наглый, несмелый и циничный, нелёгкий на подъём и трудно сдерживаемый, способный к порывам и быстро впадающий в апатию, вызывающий на борьбу свой век и льстящий ему, проклинающий свою литературную славу и вместе с тем только и думающий о том, чтобы её отстоять и увеличить, ищущий уединения и жаждущий всемирной известности, бегущий от оказываемого ему внимания и досадующий на его отсутствие, позорящий знатных и живущий в их обществе, прославляющий прелесть независимого существования и не перестающий пользоваться гостеприимством, за которое приходится платить остроумной беседой, мечтающий только о хижинах и обитающий в замках, связавшийся со служанкой и влюбляющийся только в великосветских дам, проповедующий радости семейной жизни и отрекающийся от исполнения отцовского долга, ласкающий чужих детей и отправляющий своих в воспитательный дом, горячо восхваляющий небесное чувство дружбы и ни к кому его не испытывающий, легко себя отдающий и тотчас отступающий, сначала экспансивный и сердечный, потом подозрительный и сердитый — таков Руссо».
Значение
В природе фосфор встречается в виде солей и минералов. В частности входит в состав апатита.
В организме животных и человека фосфор выполняет структурную функцию. Его содержат:
- белки;
- ДНК;
- АТФ;
- фосфолипиды;
- костная, нервная, мышечная ткани.
Фосфор участвует в постройке клеточной мембраны, в метаболизме, в механизме сокращения мышц. Вместе с кальцием в виде фосфата кальция Са3(PO4)2 придаёт прочность скелету.
Фосфор участвует в круговороте веществ. Основной источник фосфора – растения, получающие его из почвы. В грунт фосфор попадает в результате гниения. Специальные бактерии перерабатывают органические вещества, содержащие фосфор, в фосфаты – неорганические соединения, усвояемые растениями.
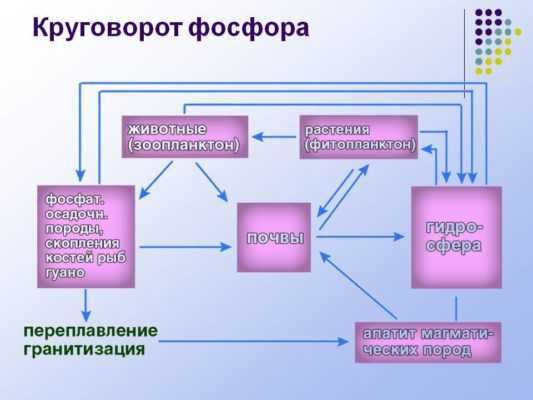 Рис. 3. Круговорот фосфора.
Рис. 3. Круговорот фосфора.
Что мы узнали?
Фосфор – один из важнейших элементов неорганической химии, входящий в состав живых организмов. Электронная конфигурация – 1s22s22p63s23p3. Имеет переменную валентность – III и V.Это твёрдый неметалл, образующий три аллотропические формы – белый, красный и чёрный фосфор. Формы отличаются физическими и химическими свойствами. Самый активный – белый фосфор, окисляющийся на воздухе. Элемент реагирует с кислородом, металлами, неметаллами, галогенами, кислотами, водой и щелочами. Фосфор не реагирует с водородом.
-
/10
Вопрос 1 из 10
Физические и химические свойства
Фосфор способен образовывать разнообразные простые вещества, то есть аллотропные модификации. В нормальных условиях вещество характеризуется твердым агрегатным состоянием. Основные аллотропные модификации фосфора:
- белый;
- красный;
- черный.
Они отличаются по таким показателям, как:
- строение кристаллической решетки;
- цвет;
- плотность;
- физические характеристики;
- химическая активность.
В процессе трансформации вещества в более термодинамически устойчивую модификацию показатели химической активности снижаются. В качестве примера можно привести последовательное превращение белого фосфора в красный, затем красного в черный.
Белый фосфор представляет собой вещество состава . Мягкое вещество белого цвета является ядовитым и обладает характерным чесночным запахом. Вещество характеризуется молекулярной кристаллической решеткой, что объясняет невысокую температуру плавления в 44°С и высокую летучесть. Белый фосфор плавится в резервуаре с подогретой водой, реакционно способен и может самовоспламеняться на воздухе.
Красный фосфор представляет собой модификацию с атомной кристаллической решеткой. В химии формула вещества Pn или простоP. Красный фосфор характеризуется полимерным строением со сложной структурой. Материал в твердом агрегатном состоянии не обладает запахом, имеет красно-бурый цвет, не является ядовитым. Данная модификация более устойчива по сравнению с белым фосфором. Вещество образуется из белого фосфора при температуре от 250°С до 300°С в безвоздушной среде.
Черный фосфор является наиболее стабильной термодинамически и наименее активной химически формой элементарного фосфора. Вещество обладает черной окраской и имеет металлический блеск. Материал жирный на ощупь и обладает некоторыми сходствами с графитом. Черный фосфор не растворяется в воде и в растворителях органического происхождения.
Существуют и другие разновидности фосфора, в том числе, желтый и металлический фосфор. В первом случае вещество является неочищенным белым фосфором. В условиях повышенного давления желтый фосфор трансформируется в новую модификацию под названием металлический фосфор, который является хорошим проводником электрического тока.
Фосфор проявляет химическую активность при обычных условиях и при нагревании. В окислительно-восстановительных реакциях может выступать как:
- окислитель с элементами, которые расположены ниже и левее в Периодической системе;
- восстановитель с элементами, расположенными выше и правее.
В связи с этим, фосфор вступает в химические реакции с металлами и неметаллами.
Лидер левых сил
После нового избрания в парламент Жорес становится главной фигурой в стане социалистов. Его признают лидером всех социалистических партий. Несмотря на это, политик так и не сформулировал чётко свои взгляды и причины симпатий к социализму. Тем не менее он активно занимается объединением всех левых ради борьбы с существующим строем. Популярность в кругу радикалов во многом обеспечена ораторским мастерством философа. Его громкие речи затрагивают не только социалистов, но и буржуазную интеллигенцию других взглядов. В качестве движущей силы для борьбы за социальные права народа Жорес называет «социальную ненависть», что, безусловно, перекликается с классовой борьбой Маркса.
Фосфор
Реферат на тему «Фосфор»
Распространенность в природе
Массовая доля фосфора в земной коре составляет 0,08%.
Важнейшими минералами фосфора, встречающимися в природе, являются фторапатит Ca5(PO4)3F и фосфорит Ca3(PO4)2.
Свойства
Фосфор образует несколько аллотропных модификаций, которые заметно различаются по свойствам. Белый фосфор — мягкое кристаллическое вещество.
Состоит из молекул P4. Плавится при температуре 44,1°С.
При нагревании белого фосфора образуется Красный фосфор. Он представляет собой смесь нескольких модификаций, которые имеют различную длину молекул. Цвет красного фосфора в зависимости от способа и условий получения может меняться от светло-красного до фиолетового и темно-коричневого. Температура его плавления 585-600°.
Черный фосфор — наиболее устойчивая модификация. По внешнему виду он похож на графит. В отличие от белого фосфора красный и черный фосфор не растворяются в сероуглероде, они не ядовиты и не огнеопасны.
Фосфор химически более активен, чем азот. Химическая активность фосфора зависит от аллотропной модификации, в которой он находится. Так, наиболее активен белый фосфор, а наимнее активен черный фосфор.
В уравнениях химических реакций белый фосфор обычно записывают формулой P4, которая соответствует составу его молекул. Красная и черная модификации фосфора обычно записываются формулой P. Этот же символ используют, если модификация неизвестна или может быть любой.
1. Взаимодействие с простыми веществами — неметаллами. Фосфор может реагировать со многими неметаллами: кислородом, серой, галогенами, с водородом фосфор не реагирует.
В зависимости от того, находится фосфор в избытке или недостатке, образуются соединения фосфора (III) и (V), например: 2P + 3Br2 = 2PBr3 или 2P + 5Br2 = 2PBr5
2. Взаимодействие с металлами. При нагревании фосфора с металлами образуются фосфиды: 3Mg + 2P = Mg3P2
Фосфиды некоторых металлов могут разлагаться водой с образованием газообразного фосфина PH3: Mg3P2 + 6H2O = 3Mg(OH)2 + 2PH3
Фосфин PH3 по химическим свойствам похож на аммиак NH3.
3. Взаимодействие со щелочами. При нагревании белого фосфора в растворе щелочи он диспропорционирует:
0 -3 +1
P4 + 3NaOH + 3H2O = PH3 + 3NaH2PO2
Получение.
Фосфор в промышленности получают из фосфата кальция Ca3(PO4)2, который выделяют из фосфоритов и фторапатитов. Метод получения основан на реакции восстановления Ca3(PO4)2 до фосфора.
В качестве восстановителя соединений фосфора используют кокс (углерод). Для связывания соединений кальция в реакционную систему добавляют кварцевый песок SiO2. Процесс проводят в электопечах (производство относят к электротермическим).
Продукт реакции — белый фосфор. Из-за наличия примесей технический фосфор имеет желтый цвет, поэтому в промышленности его называют желтым фосфором.
Фосфорные удобрения
Фосфор, так же как и азот, является важным элементом для обеспечения роста и жизнедеятельности растений. Растения извлекают фосфор из почвы, поэтому его запасы необходимо восполнять, периодически добавляя фосфорные удобрения. Фосфорные удобрения производят из фосфата кальция, который входит в состав природных фосфоритов и фторапатитов.
Простейшее фосфорное удобрение — фосфоритная мука представляет собой перемолотый фосфорит Ca3(PO4)2. Это удобрение труднорастворимо, оно может усваиваться растениями только на кислых почвах.
Действием серной кислоты на фосфат кальция получают простой суперфосфат, основным компонентом которого является дигидрофосфат кальция Ca(H2PO4)2. Это — растворимое вещество, и оно хорошо усваивается растениями. Метод получения простого суперфосфата основан на реакции Ca3(PO4)2 + 2H2SO4 = Ca(H2PO4)2 + 2CaSO4
Кроме основного компонента суперфосфат содержит до 50% сульфата кальция, который является балластом.
Для повышения содержания фосфора в удобрении проводят обработку фосфорита фосфорной кислотой: Ca3(PO4)2 + 4H3PO4 = 3Ca(H2PO4)2
Получаемое удобрение называется двойным суперфосфатом. Еще одно фосфорное удобрение с высоким содержанием фосфора — преципитат CaHPO4·2H2O.
При взаимодействии полифосфорных кислот с аммиаком образуются полифосфаты аммония, которые используются как комплексные азотно-фосфорные удобрения.
Вместе с азотом фосфор входит в состав некоторых других комплексных удобрений, например аммофоса NH4H2PO4 и диаммофоса (NH4)2HPO4.
Фосфористая кислота ( H3PO3)
Способы получения фосфористой кислоты
Гидролиз галогенидов фосфора (III):
Окисление белого фосфора хлором:
Физические свойства, строение фосфористой кислоты
Для молекулы фосфористой кислоты H3PO3 известны 2 таутомерные формы. В одной из них 2 атома водорода молекулы связаны с кислородом, а один атом водорода связан непосредственно с атомом фосфора. Такой атом водорода не может быть замещен атомами металлов, поэтому кислота является двухосновной.
В другой таутомерной форме – все три атома водорода связаны с кислородом.
Формула фосфористой кислоты выглядит следующим образом: Н2[НРО3]
При комнатной температуре H3PO3 – кристаллическое вещество без цвета, хорошо растворимое в воде, Тпл = 74°С.
Валентность фосфора в фосфористой кислота равна V, а степень окисления +3.
Химические свойства фосфористой кислоты
Является слабой кислотой.
Для нее характерны все свойства кислот — взаимодействие с металлами с выделением Н2; с оксидами металлов и с щелочами. При этом образуются одно — или двухзамещенные фосфиты:
Кислота является и окислителем и восстановителем, при нагревании вступая в реакции диспропорционирования:
Кислота и ее соли являются сильными восстановителями:
Реагируют с сильными окислителями:
Реагируют с более слабыми окислителями:
В реакции с сильными восстановителями, например, с щелочными и щелочно-земельными металлами, цинковой пылью, кислота восстанавливается до фосфина:
При нагревании водного раствора Н3РO3окисляется до H3PO4 с выделением водорода:
Убийство философа накануне войны
Угрозы в свой адрес Жан получал на протяжении года. Францию охватила националистическая истерия.

Националисты ненавидели пацифистов, а правительство только подстрекало такие настроения. В итоге тридцать первого июля 1914 года Жорес был убит в центре Парижа националистом Раулем Вилленом.
В середине двадцатого века Жореса реабилитировали. Его именем названы улицы во Франции, Германии и на территории бывшего Советского Союза. Он стал настоящим символом борьбы за человечность во время братоубийственной войны. В Париже ему установили памятник.

Краткая биография Жана Жореса была представлена в советских учебниках по истории и политологии.
Фосфин (PH3)
Способы получения фосфина
Прямым синтезом PH3получить нельзя.
Фосфин получают путем водного или кислотного гидролиза фосфидов:
Реакция диспропорционирования фосфора в щелочах:
Разложение солей фосфония (Температура выше 80ºС):
Физические свойства фосфина
При нормальной температуре фосфин является бесцветным газом с резким чесночным запахом. В воде малорастворим, хорошо растворим в органических растворителях
Фосфин — Яд!
Химические свойства фосфина
PH3не реагирует с водой, щелочами, аммиаком.
PH3 — Проявляет свойства сильного восстановителя.
Вступает в реакции с кислотами – окислителями:
С безводными кислотами образует соли:
- Окисляется кислородом. При Т
Практического значения фосфин не имеет.
Химические свойства
Как мы писали выше, фосфор занимает 15 место в периодической таблице Менделеева и входит в одну группу с азотом, мышьяком и сурьмой. Хотя на валентном уровне он и имеет целых 5 электронов, однако 5 связей образуются довольно редко.

Фосфор – очень химически активный элемент, особенно белый фосфор. Как следствие он может вступать в самые разнообразные химические реакции, выступая как в качестве окислителя (с элементами, расположенными ниже и левее в таблице Менделеева), так и восстановителя (с элементами, расположенными выше и правее в таблице Менделеева).
При взаимодействии с кислородом воздуха образуются оксиды – ангидриды соответствующих кислот:
4P +3O2 > 2P2O3
4P + 5O2 > 2P2O5
При взаимодействии фосфора с галогенами образуются галогениды с общей формулой PHal3 и PHal5:
2P + 3Cl2 > 2PCl3
2P + 5Cl2 > 2PCl5
При взаимодействии фосфора с серой образуются сульфиды:
2P + 3S > P2S3
2P + 5S > P2S5
При взаимодействии с металлами фосфор проявляет свойства окислителя, продукты реакции называют фосфидами.
Например, кальций и магний реагируют с фосфором с образованием фосфидов кальция и магния:
2P + 3Ca > Ca3P2
2P + 3Mg > Mg3P2
Физические свойства фосфора:
| 400 | Физические свойства | |
| 401 | Плотность | 1,823 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело) – белый фосфор,
≈2,2-2,34г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело) – красный фосфор, 2,36 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело) – фиолетовый фосфор, 2,69 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело) – чёрный фосфор |
| 402 | Температура плавления | 44,15 °C (317,3 K, 111,5 °F) – белый фосфор,
≈590 °C (≈860 K, ≈1090 °F) – красный фосфор |
| 403 | Температура кипения | 280,5 °C (553,7 K , 536,9 °F) – белый фосфор |
| 404 | Температура сублимации | ≈416-590 °C (≈689,2-863 K, ≈780,8-1094 °F) – красный фосфор,
620 °C (893 K, 1148 °F) – фиолетовый фосфор |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 0,66 кДж/моль – белый фосфор |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 51,9 кДж/моль – белый фосфор |
| 409 | Удельная теплоемкость при постоянном давлении | |
| 410 | Молярная теплоёмкость | 23,824 Дж/(K·моль) – белый фосфор |
| 411 | Молярный объём | 16,99054 см³/моль |
| 412 | Теплопроводность | 0,236 Вт/(м·К) (при стандартных условиях) – белый фосфор,
12,1 Вт/(м·К) (при стандартных условиях) – красный фосфор, 0,236 Вт/(м·К) (при 300 K) – белый фосфор |
| 413 | Коэффициент теплового расширения | |
| 414 | Коэффициент температуропроводности | |
| 415 | Критическая температура | |
| 416 | Критическое давление | |
| 417 | Критическая плотность | |
| 418 | Тройная точка | |
| 419 | Давление паров (мм.рт.ст.) | |
| 420 | Давление паров (Па) | |
| 421 | Стандартная энтальпия образования ΔH | |
| 422 | Стандартная энергия Гиббса образования ΔG | |
| 423 | Стандартная энтропия вещества S | |
| 424 | Стандартная мольная теплоемкость Cp | |
| 425 | Энтальпия диссоциации ΔHдисс | |
| 426 | Диэлектрическая проницаемость | |
| 427 | Магнитный тип | |
| 428 | Точка Кюри | |
| 429 | Объемная магнитная восприимчивость | |
| 430 | Удельная магнитная восприимчивость | |
| 431 | Молярная магнитная восприимчивость | |
| 432 | Электрический тип | |
| 433 | Электропроводность в твердой фазе | |
| 434 | Удельное электрическое сопротивление | |
| 435 | Сверхпроводимость при температуре | |
| 436 | Критическое магнитное поле разрушения сверхпроводимости | |
| 437 | Запрещенная зона | |
| 438 | Концентрация носителей заряда | |
| 439 | Твёрдость по Моосу | |
| 440 | Твёрдость по Бринеллю | |
| 441 | Твёрдость по Виккерсу | |
| 442 | Скорость звука | |
| 443 | Поверхностное натяжение | |
| 444 | Динамическая вязкость газов и жидкостей | |
| 445 | Взрывоопасные концентрации смеси газа с воздухом, % объёмных | |
| 446 | Взрывоопасные концентрации смеси газа с кислородом, % объёмных | |
| 446 | Предел прочности на растяжение | |
| 447 | Предел текучести | |
| 448 | Предел удлинения | |
| 449 | Модуль Юнга | |
| 450 | Модуль сдвига | |
| 451 | Объемный модуль упругости | |
| 452 | Коэффициент Пуассона | |
| 453 | Коэффициент преломления |
Применение
Фосфор является важнейшим биогенным элементом и в то же время находит очень широкое применение в промышленности. Красный фосфор применяют в производстве спичек. Его вместе с тонко измельчённым стеклом и клеем наносят на боковую поверхность коробки. При трении спичечной головки, в состав которой входят хлорат калия и сера, происходит воспламенение.
Элементарный фосфор
Пожалуй, первое свойство фосфора, которое человек поставил себе на службу, — это горючесть. Горючесть фосфора очень велика и зависит от аллотропической модификации.
Наиболее активен химически, токсичен и горюч белый («жёлтый») фосфор, потому он очень часто применяется (в зажигательных бомбах и пр.).
Красный фосфор — основная модификация, производимая и потребляемая промышленностью. Он применяется в производстве спичек, взрывчатых веществ, зажигательных составов, различных типов топлива, а также противозадирных смазочных материалов, в качестве газопоглотителя в производстве ламп накаливания.
Соединения фосфора в сельском хозяйстве
Фосфор (в виде фосфатов) — один из трёх важнейших биогенных элементов, участвует в синтезе АТФ. Большая часть производимой фосфорной кислоты идёт на получение фосфорных удобрений — суперфосфата, преципитата, аммофоски и др.
Соединения фосфора в промышленности
Фосфаты широко используются:
- в качестве комплексообразователей (средства для умягчения воды),
- в составе пассиваторов поверхности металлов (защита от коррозии, например, т. н. состав «мажеф»).
Фосфатные связующие
Способность фосфатов формировать прочную трёхмерную полимерную сетку используется для изготовления фосфатных и алюмофосфатных связок.

Слайды и текст этой презентации
Слайд 1ФосфорI Фосфор – химический элемент1. Положение фосфора в периодической системе
химических элементов.
Строение атома.
1. Аллотропные модификации фосфора.
2. Химические свойства.
3. Применение фосфора
III. Тест
II. Фосфор – простое вещество

Слайд 3Белый фосфор — твердое кристаллическое вещество, плотность его 1,82 г/см3.
На воздухе самовоспламеняется, в темноте светится. Получают быстрым охлаждением паров
фосфора. Очень ядовит.Красный фосфор — порошок темно-красного цвета, плотность его 2,2 г/см3. Получают длительным нагреванием белого фосфора без доступа воздуха при температуре 250-300°С. По своим свойствам отличается от белого, не ядовит.Черный фосфор — твердое вещество, плотность его 2,7 г/см3. Образуется при нагревании белого фосфора при температуре 200 °С под высоким давлением. Используется в производстве спичек, снарядов и т. д.

Слайд 6Химические свойства фосфораP0P + O2 (S, Cl2)P+5 (P+3)восстановительокислительP + МеP–31)
с кислородом II. Взаимодействие фосфора с металламиI. Взаимодействие фосфора с
неметаллами
III. Взаимодействие фосфора со сложными веществами
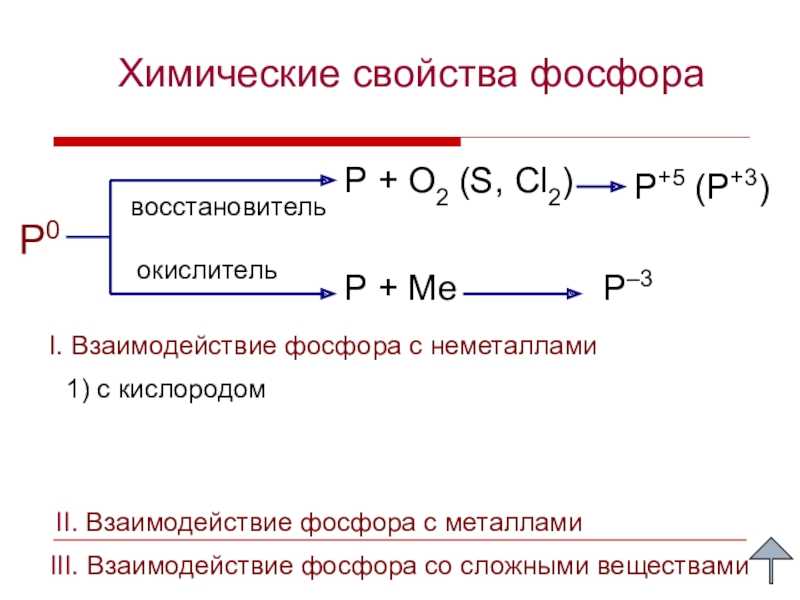
Слайд 7I. Взаимодействие фосфора с неметаллами Составьте уравнения реакций
взаимодействия фосфора с кислородом. Назовите окислитель и восстановитель.P0 +
O20 = P2+5O5–2
P0 –5e → P+5 5 4O20 + 4e → 2O–2 4 5
4
5
2
Р0 – восстановитель, процесс окисления;О20 – окислитель, процесс восстановления
Опыт №1
Опыт №2
При окислении фосфора в недостатке кислорода образуется Р2О3
4P0 +3O20 =2P2+5O3–2
Взаимодействие фосфора с кислородом

Слайд 9III. Взаимодействие фосфора с металлами Взаимодействие фосфора с кальцием Опыт
Составьте уравнение реакции взаимодействия фосфора с кальцием, назовите окислитель
и восстановитель.
P0 + Ca0 = Ca3+2P2–3
P0 + 3e → P–3 3 2Ca0 — 2e → Ca+2 2 3
2
3
Р0 – окислитель, процесс восстановления;Cа0 – восстановитель, процесс окисления.

получения фосфорных кислот и их производных.Основная область применения красного фосфора
– производство спичек
Фосфор применяется как раскислитель и компонент некоторыхметаллических сплавов
Производство лекарственныхпрепаратов
Средства борьбы с вредителямисельского хозяйства
Производство моющих средств
Органический синтез
Р2О5 как осушитель газов ижидкостей

Слайд 111. В каком из перечисленных соединений степень окисления фосфора +3
А) Р2О5; Б) NaPO3;
В) PCl3
2. В какой из приведенных пар оба вещества взаимодействуют с фосфором: А) кальций и соляная кислота; Б) натрий и кислород; В) кислород и соляная кислота.
А
Б
В
3. Составьте уравнение реакции фосфора с кальцием. Коэффициент перед формулой окислителя: А) 2; Б) 3); В) 1.
4. Как хранят красный фосфор в лаборатории: А) под слоем воды; Б) под слоем керосина; В) в обычных условиях.
В
5. Фосфор образует простое вещество с молекулярной кристаллической решеткой, в узлах которой находятся молекулы Р4. какой цвет имеет такой фосфор: А) красный; Б) желтый; В) зеленый.
Б
6. Степень окисления фосфора увеличивается в ряду: А) PH3, P2O3, H3PO4; Б) Na3PO4, P2O5, HPO3; В) Ca3P2, PH3, NaPO3
А
7. Какое из утверждений неверно: «Атом фосфора по сравнению с атомом азота имеет»: А) больший радиус; Б) больший заряд ядра; В) более ярко выраженные неметаллические свойства.
В















![§ 32. фосфор [1971 ходаков ю.в., эпштейн д.а., глориозов п.а. - неорганическая химия. учебник для 9 класса]](http://santekhlux.ru/wp-content/uploads/f/3/0/f30d3ba301a1bf0662a076252fa491a6.jpeg)














